联系人:沈经理
手 机:16602150044
电 话:400-663-2276
地 址:上海市嘉定区华江公路688号凯迪大厦210室
性能的影响
(来源:期刊-《原子能科学技术 》- 第38卷第4期)
张 华1,王长福2,贺 诚1,孙惠琳1,毛潇梵1,王志恒1
( 1. 中国原子能科学研究院放射化学研究所,北京 102413;2. 东华理工大学核科学与工程学院,江西 南昌 330013)
摘要:随着反应堆乏燃料燃耗的升高,高放废液中镧系和锕系元素含量增多。本文针对高燃耗乏燃料高放 废液中含量较高的氧化镨对高钠硼硅酸盐玻璃结构和性能的影响进行研究 。结果显示,在废物包容量 10wt.% 条件下,氧化镨添加量 10wt.% 的玻璃样品仍可维持均匀的玻璃无定形结构。拉曼分析结果显示, 随着氧化镨的添加,1 065 cm−1附近的峰有向左偏移的趋势,玻璃结构 Q3 占比出现减少趋势。 29Si 固态核磁分析结果显示,随着废物添加量的增加和氧化镨的加入,Q4 和 Q3 占比呈先减少后增加的趋势,同时 Q2 和 Q1 占比呈先增加后减少的趋势,表明废物添加量的增加和氧化镨的加入使得玻璃网络结构聚集度呈先降低后提高,氧化镨主要充当网络结构调节剂。化学稳定性测试结果显示,在废物包容量 0wt.% 条件下,随着氧化镨的加入,元素浸出率升高;在废物包容量 10wt.% 条件下,随着氧化镨的加入,元素浸出率逐步下降。表明废物包容量的增加和氧化镨的添加能够促进玻璃网络结构趋于聚集和稳定化,提高化学稳定性。
关键词:高放废液;玻璃结构;氧化镨
中图分类号:TL941.33 文献标志码:A 文章编号:1000-6931(2025)08-1621-09
doi:10.7538/yzk.2024.youxian.0742
玻璃固化技术经历了半个多世纪的研发,已从第一代罐式熔炉法发展到第四代两步法冷坩埚 熔炉法,现已成为普遍认可的安全、有效的高放废液处理技术,并已在法国、美国、英国、印度、 德国、比利时等国家实现工业规模生产[1-2]。我国从 20 世纪 70 年代开始一直致力于玻璃固化工 艺、设备及玻璃固化基础配方的研发和工程化应用,其中高放废液中放射性元素在玻璃固化结构 中的作用及其对玻璃固化性能的影响研究对玻璃固化基础配方研发、玻璃固化工艺及设备的顺利 运行有着不可忽视的作用。
玻璃结构中的氧化物主要有 3 种:网络生成体氧化物、网络外氧化物、中间体氧化物 [2-3]。高放废液玻璃固化基材主要为硼硅酸盐玻璃,其中硼和硅作为网络生成体氧化物,同时过渡金属 Al、Fe 等主要为中间体氧化物;碱金属和碱土金属,如 Na、Ca 等则通常为网络外氧化物。随着反应堆燃耗的升高,过渡金属、镧系元素和锕系元素的含量逐步增加,镧系元素( La、Nd、Gd、Pr、 Sm 等)和锕系元素含量的升高必然会对硼硅酸盐玻璃结构产生影响。文献 [4-5] 研究显示,La 在玻璃固化体结构中主要是充当网络调节剂因而无法进入玻璃网络结构。本项目组研究[6] 显示,Gd 含量对高钠玻璃固化体结构有一定解聚作用,同时还可提高该种玻璃固化体的化学稳定性。在动力堆乏燃料高放废液中Pr 作为含量仅次于 La、Nd、 Ce 的镧系元素,可在玻璃熔制过程中同氧化铝等氧化物团聚形成复合氧化物,促进玻璃析晶趋势等现象发生[7-8]。目前,氧化镨对玻璃固化结构影响的研究较少,为了对后续高燃耗高放废液玻璃固化配方的设计提供依据,并评估氧化镨含量对玻璃固化产品结构和性能的影响,本文针对氧化镨对硼硅酸盐玻璃结构及化学稳定性的影响进行研究。项目组已针对摩尔比为 SiO2 ∶B2O3 ∶Na2O=1 ∶0.23 ∶0.54 型高钠硼硅酸盐基础玻璃配方开展了高废物包容量 20wt.% 条件下废物氧化物添加对其结构的影响研究[6],结果显示,高废物包容量条件下玻璃固化体有较好的结构稳定和化学稳定性,且会随着废物氧化物的添加而逐步增强。由于该玻璃配方钠元素含量较高,玻璃结构聚集性和化学稳定性偏低,开展该玻璃配方低废物包容量条件下玻璃结构和化学稳定性变化研究有助于了解废物包容量和元素添加量对其的影响机制。
因此 ,本文采用该玻璃配方研究动力堆33 GW·d/tU 乏燃料模拟高放废液低废物包容量条 件下,氧化镨添加量对玻璃固化体结构和化学稳定性的影响,以期获得该玻璃配方在包容模拟高 放废液基础上对氧化镨的冗余度,以及该玻璃配方在低废物包容量和不同氧化镨添加量条件下形 成的玻璃固化体化学稳定性和结构聚集性的变化趋势。
1 试验设计及样品熔制
1.1 试验设计
为了研究动力堆 33 GW·d/tU 乏燃料模拟高放废液包容量及氧化镨添加量对高钠玻璃结构 和性能的影响,设计了废物包容量 为 0wt. % 、 5wt . % 、10wt. % 条件下氧化镨添加量分别 为 2wt.%、6wt.% 和 10wt.% 的玻璃组成,如表 1 所列。其中,样品编号为废物包容量(0 代表0wt.%, 5 代表 5wt.%,10 代表 10wt.%)P-氧化镨添加量( 1 代表 2wt.%,2 代表 6wt.%,3 代表 10wt.%),如 0P-1、5P-1、10P-1 等。
1.2 样品制备
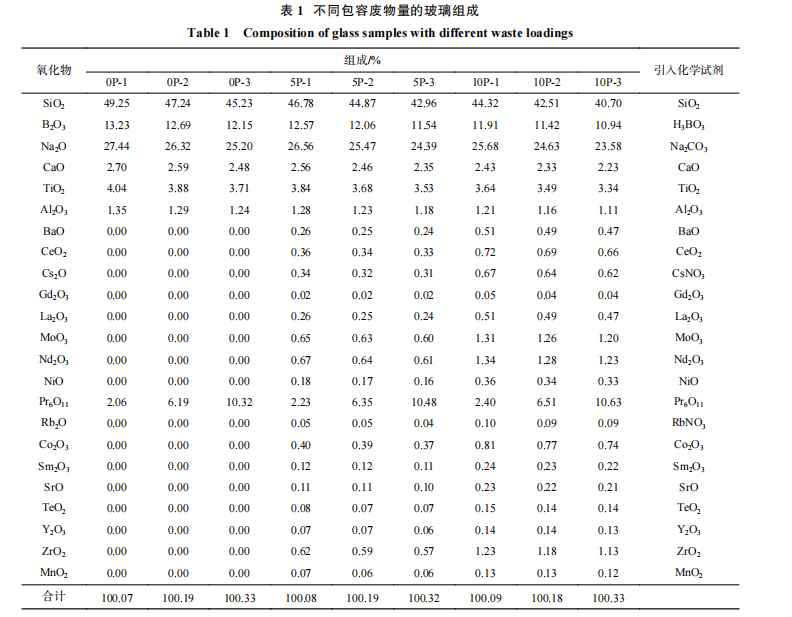
依据表 1,分别称取上述氧化物等化学试剂, 混合均匀后放入石英坩埚,在 1 150 ℃ 条件下熔制 3 h,之后浇注于事先加热的石墨模具中,脱模后放入 500 ℃ 退火炉中退火,并以 1 ℃/min 速率降至室温后,取出。 将上述样品进行粉碎、过筛,选择粒径为 100~200 目的粉末样品,放入超声波清洗器,用乙醇清洗 3 次,每次 2 min,用去离子水清洗 3 次后放入烘箱待用。实验制备的 9 个样品的 实物图如图 1 所示。由图 1 可见,废物包容量为 0wt.% 条件下,3 个样品较为透明,随着废物添加量增加至 5wt.% 和 10wt.%,玻璃样品颜色加深至 黑色,9 个样品均无表面分相出现,显示获得的 9 个样品为均匀的玻璃样品。
2 分析方法
2.1 X 射线衍射( XRD )分析
采用德国 Bruke 公司 D8 Venture 型 X 射线衍射仪对玻璃样品晶相进行分析。测量条件为:Cu Kα 射线,波长 0.154 18 nm,管压 40 kV,管流 40 mA,扫描范围 10°~ 70°( 2θ), 步长 0.01°,扫描速度 0.8 s/步。
2.2 拉曼( Raman )光谱分析
采用英国 Renishaw拉曼光谱仪对玻璃样品网络结构进行分析。测量条件为:532 nm 绿光激发,波数范围 100~2 000 cm−1,每次测量前采用硅单质进行校正,扫描范围 400 ~ 1 400 cm−1,扫描频次 20。
2.3 扫描电镜( SEM-EDS )分析
采用 FEI 公司 Nova NanoSEM450 场发射扫描电子显微镜对样品表面形貌及能谱进行分析。测量条件为:加速电压 50 V~30 kV,连续可调电子束流可达 200 nA,放大倍数 100~600 000。分辨率:高真空,1.0 nm( 15 kV)、1.4 nm( 1 kV);低真空,1.8 nm( 3 kV,Helix 探头)。聚焦范围:模式 Ⅰ 为 1~60 mm,模式Ⅱ为 1~7 mm(1 kV)。
2.4 固态核磁( 29Si-MAS-NMR )分析
采用德国 Bruker 400M 高分辨率固态核磁共振谱仪对样品中硅的结构、玻璃网络聚合度进行分析。测量条件为:MAS 自旋速率,10 kHz;回收时间,4 s;预扫描延迟,6.5 μs;4 mm 高分辨魔角微量探头。
2.5 化学稳定性测试( PCT 法)
参照 ASTM C1285-14 标准[9] 规定的 PCT-B 方法进行元素的化学稳定性测试,每个样品均测量 3 个平行样和 3 个空白样,根据计算结果称取粒径为 100~200 目的玻璃样品,依次用去离子水和乙醇超声清洗至溶液澄清。按照 SA/ V=1 800 m−1 将玻璃样品和超纯水加入到容器内,最后放入预热烘箱内((90±2)℃) 。分别测量 Si、B、Na、Pr 在 1、3、7、14、28 d 的归一化浸出率(NRi)。NRi 计算公式如下:
(1)
式中:ci 为预定时间样品中 i 种元素的浓度,g/L; c0 为空白样品中 i 种元素的本底浓度,g/L;SA 为样品表面积,m2;V 为浸出液体积,m3;SA/ V 为比表面积,m−1;fi 为 i 种元素在玻璃中的质量百分比;t 为浸出时间,d。
实验完成后取一部分浸泡液测量 pH,其余浸泡液用 0.45μm 的过滤器过滤至离心管中,酸化后( 滴加0.025 mL 的浓硝酸)采用美国热电公司的 iCAP-7400 电感耦合等离子体光谱仪分析浸出液中元素含量。
3 结果分析及讨论
3.1 XRD 分析
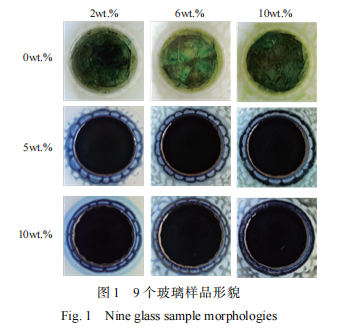
不同废物含量及氧化镨添加量玻璃样品的 XRD 分析结果如图 2 所示。图中 9 个玻璃样品(0P-1~3、5P-1~3、10P-1~3)都在 20°~40°之间 呈现出一个无定形宽峰,没有明显析晶峰出现,未出现同氧化铝形成的复合氧化物析晶相。 9 个样品均呈现非晶玻璃态,表明废物包容量的增加及氧化镨的添加没有对玻璃网络结构造成明显影响,没有形成析晶相。进一步可知,该玻璃配方对于该类废液的包容量 10wt.% 及氧化镨添加量为 10wt.% 时未达到饱和,玻璃样品仍可维持无定形玻璃结构。
3.2 SEM-EDS 分析
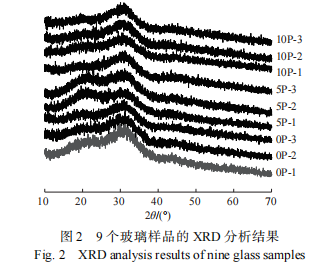
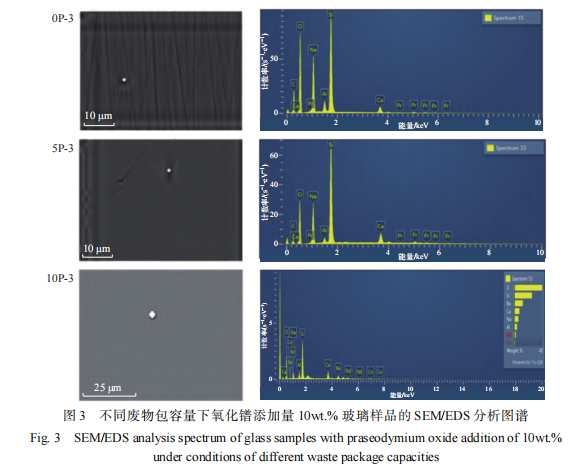
为进一步确认玻璃样品是否形成析晶相,采用扫描电镜进行样品表面形貌分析。由于玻璃网络会随着废物包容量的增加趋向包容量饱和及析晶,上述 9 个玻璃样品中废物包容量最大为 10wt.% 且氧化镨添加量最大为 10wt.% 的样品趋向饱和和析晶的可能性最大。因此,考虑代表性和对比性采用扫描电镜选择废物添加量为 0wt. % 、 5wt.%、10wt.% 且氧化镨的最大添加量为 10wt.% 的样品(0P-3、5P-3 和 10P-3)进行形貌和能谱分析,如图 3 所示。结果显示,废物包容量 0wt.%、 5wt.%、10wt.%,氧化镨添加量 10wt.% 的 3 个样品表面均没有出现析晶相,分析区域元素组成与玻璃基体组分基本一致。由分析结果可知,9 个样 品表面都没有析晶相形成,该结果同 XRD 分析结果一致。
3.3 拉曼分析
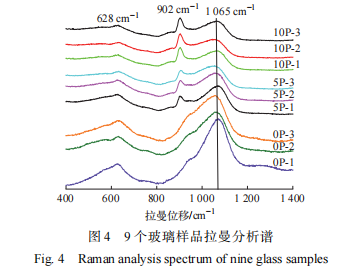
硼硅酸盐玻璃固化体结构中 Si-O 键的主要拉曼峰在 600 ~ 1 200 cm − 1 范围,其中低频区( 300~800 cm−1)显示玻璃结构中的中程分子结构,高频区(800~ 1 200 cm−1)显示 Si 在玻璃中形成的 Q n 结构 [ 10 − 12 ],Si-O 键的 Q n 拉曼峰出现在 845 cm−1(Q1)、897 cm−1(Q4(B))、940 cm−1(Q2)、 1 040 cm−1(Q3)和 1 150 cm−1(Q4),反映玻璃主体结构情况。拉曼分析结果示于图4。
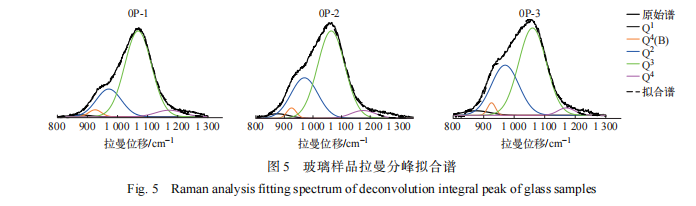
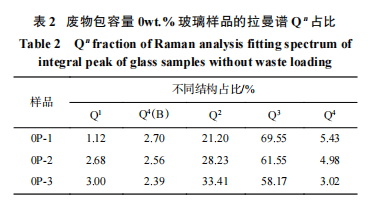
由 图 4 可见,在 400 ~ 1 400 cm − 1 区间出现 3 个峰,即 628、902 、1 063 cm−1。废物添加量为 0wt.%、5wt.%、10wt.% 时,在 800 ~1 200 cm−1 出现 Si-O 键高频区谱峰。其中,当废物添加量为 5wt.% 和 10wt.%时,在 900 cm−1 附近出现较为尖锐的拉曼衍射峰且随废物添加量的增加谱峰高度逐步增加。对该位置拉曼谱峰的研究 [13-15] 显示, 该位置拉曼谱峰受到无定形 NaMoO4 峰的影响,且该无定形峰位置同 Q 1 和 Q2 位置有重叠,并对废物添加量 5wt.% 和 10wt.% 样品的 Si-O 键高频区分峰拟合分析结果准确性造成影响,因此本研究只对没有废物添加量的 3 个玻璃样品进行分峰拟合,分峰拟合结果示于图 5,Qn 占比列于表2。
图 4 显示,1 065 cm−1 位置的拉曼峰会随着氧化镨的增加而略向左侧偏移,随着废物包容量的增加峰没有明显偏移。
由表 2 和图 5 可知,Q4 占比从 0P-1 样品的 5.43% 降低至 0P-3 样品的 3.02%,Q 1 占比从 0P-1 样品的 1.12% 增高至 0P-3 样品的 3.00%;同时注意到 Q3 占比从 0P-1 样品的 69.55% 降至 0P-3 样品的 58.17%,降幅约为 11%;同时 Q2 占比从 0P-1 样品的 21.2% 升高至 0P-3 样品的 33.41%,升高约 12%;与 Q4、Q3、Q2 和 Q1 变化幅度相比,Q4(B)占比变化幅度小于 0.5%,可以认为基本维持不变,显示氧化镨的添加可能对于 Q4(B)结构的影响较小,主要影响 Si-O 结构( Qn)。根据文献 [4-6] 可知,镧系元素在硼硅酸盐玻璃结构中一般是充当网络调节剂,且配合位一般为 6~8。随着氧化镨添加量达到 6wt.%,一方面增加了网络结构的非桥氧占比,一方面金属离子为了在玻璃结构中形成 PrOx 结构而参与争夺 Q4 和 Q3 结构 Si-O 键中的氧,从而形成更多 Q2 和 Q1 结构 Si-O 键,导致玻璃结构出现解聚趋势;当氧化镨添加量达到 10wt.%, 金属离子继续增多,为了满足金属离子自身配合结构需要进一步争夺 Q4 和 Q3 结构 Si-O 键中的氧,从而形成更多 Q2 和 Q1 结构,导致玻璃结构解聚趋势增加。
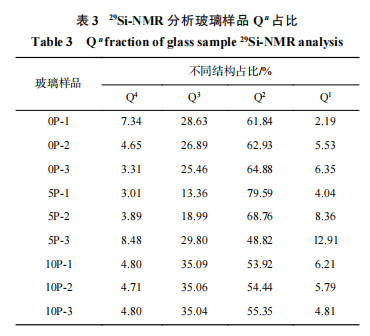
3.4 29Si-MAS-NMR 分析
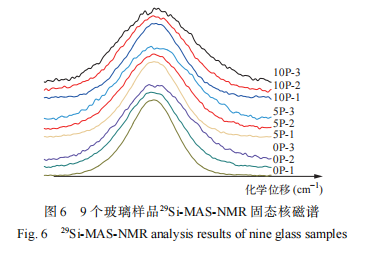
在硅酸盐玻璃样品的核磁共振谱分析结果中,硅氧四面体结构单元 Qn 具有特征化学位移范围[16-17]:Q4 (−110~−100 ppm)、Q3 (−95~−90 ppm)、 Q2 (−90~−80 ppm)和 Q1 (−76~−68 ppm)。玻璃样品的29 Si-MAS-NMR 分析结果及去卷积分峰拟合谱如 图 6、7 所示,根据 图 6、7 获得的 Q n 占比( Q1 ~Q4 占比)如表 3 所列。由表 3 、图 6 和图 7 可见,在废物包容量 0wt.% 条件下,随着氧化镨的添加 Si - O 结 构 Q 3 和 Q 4 占比逐步降低,Q 1 和 Q2 占比逐步升高,可能是金属离子为了形成配合结构需要参与争夺桥氧中的氧,从而导致玻璃结构出现解聚趋势。该结果同拉曼分析结果一致。 在废物包容量 5wt.% 条件下,Q4、Q3 和 Q1 占比都逐步上升,Q2 占比逐步下降,这可能是由于废物氧化物的添加填充了玻璃网络空隙,氧化镨含量的增加进一步促使玻璃网络结构的聚集,有利于 Q4 和 Q3 的形成。在废物包容量 10wt.% 条件下,随着氧化镨的添加,Q4 和 Q3 占比变化不大,同时 Q2 占比明显上升,Q 1 占比显著下降,显示废物氧化物 10wt.% 添加量条件下,其他金属氧化物和氧化镨含量进一步增多,金属离子为了形成多配位结构并填充玻璃网络空穴,对氧的需求增高,导致 Q1 占比下降,更多的 Q2 结构形成,随着金属氧化物配合结构的形成,玻璃结构的聚集度逐步增强。不同废物包容量的样品对比显示,废物包容量为 5wt.% 时,Q2 占比高于无废物添加,显示废物氧化物主要以网络调节剂形式进入玻璃结构,导致玻璃 Si-O 结构断裂出现解聚。废物包容量增加至 10wt.%,玻璃结构趋向紧密,可能是氧化镨等氧化物在玻璃结构空隙中形成 ROx 多配位结构所致。上述分析结果显示,在该硼硅酸盐玻璃网络结构中氧化镨仍主要充当网络调节剂。虽然,氧化镨及其他废物氧化物只能作为网络调节剂填充在玻璃网络空隙中,但由于其在玻璃网络中具有多配合位结构,仍可促进玻璃网络结构的聚集。
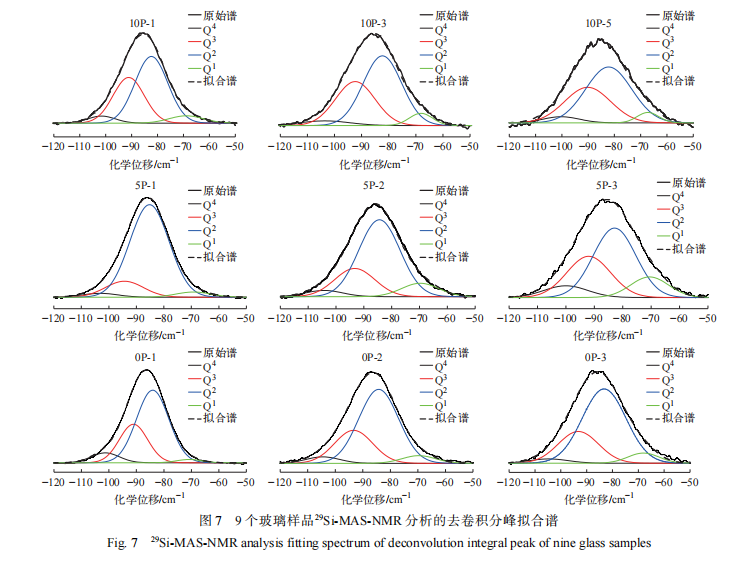
3.5 PCT 法测试结果
上述玻璃样品的拉曼和固态核磁分析结果显示,9 个样品结构的变化规律与废物包容量与氧化镨添加量密切相关。其中,废物包容量 为 0wt.% 条件下,随着氧化镨添加量的增加,玻璃样品的结构趋向逐步解聚;废物包容量为 5wt.% 条件下,氧化镨添加量增加导致玻璃结构从解聚趋势逐步向聚集趋势转变;废物添加量为 10wt.% 条件下,氧化镨添加量的增加导致玻璃固化结构逐步趋向紧密聚集。考虑到废物包容量为 5wt.% 条件下 3 个样品结构是从解聚向聚集转变的过程,PCT 浸出试验结果趋向不明显,不具有代表性。 因此,选择废物包容量分别为 0wt.% 和 10wt.% 条件下氧化镨含量为 2wt.%、6wt.%、10wt.% 的 6 个玻璃样品(0P-1~3、10P-1~3),进行 PCT 化学稳定性测试。每个玻璃样品的每个时间点设置 3 个平行样和 3 个空白样,分别在 第 1 、3 、7 、14 、 28 d 取样分析主要元素网络形成剂(Si、B)、网络调节剂(Na)和 Pr 元素的归一化浸出率,测试结果示于图 8。
图 8 显示,6 个玻璃样品的 Si、B、Na 浸出率都呈现指数递减规律,均在第 14 d 后达到稳定状态。 但 0P-1样品在第 14 d 时 Si 和 Na 的浸出率出现升高后达到浸出平衡,可能是取样均匀性所致,但未改变整体趋势。 Pr 在 6 个样品中的浸出浓度都在 20 ng/mL 以下,浸出率在 10− 4 g/(m2·d) 以下。 4 个元素在 6 个样品中浸出率的高低顺序一致,都是 Na>B>Si>Pr,其中Na 元素浸出率最高,符合其作为网络调节剂最先浸出的行为特 点。 B 元素和 Si 元素较低的浸出率符合其作为网络形成剂行为。 Pr 元素浸出率最低,一方面可能是含量较低,另一方面可能是 Pr 元素与 Na 元素虽然同为网络调节剂,其形成的 PrOx 结构稳定性大于 Na 元素,导致其浸出率较低。
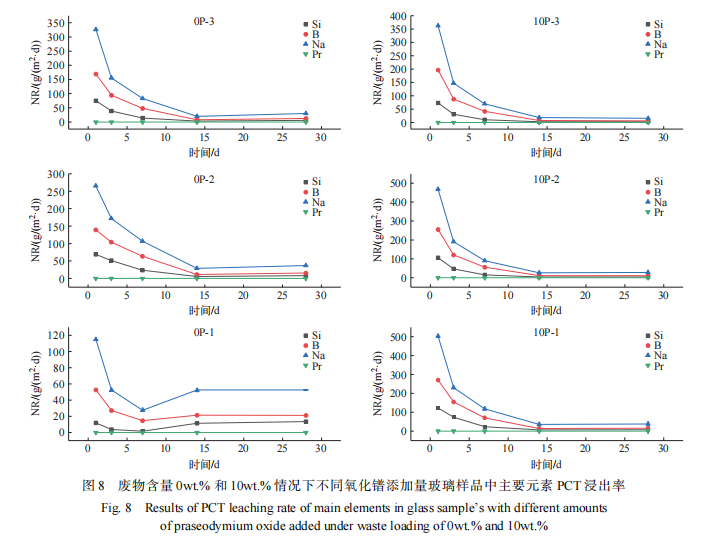
在废物包容量 0wt.% 条件下,随着氧化镨添加量的增加,Si、B、Na 的浸出率逐步上升,玻璃结构化学稳定性下降,显示氧化镨在废物包容量 0wt.% 的 3 个样品结构中充当网络调节剂,而不是网络中间体或形成剂,无法促进玻璃网络结构的聚集。在废物包容量为 0wt. % 条件下的 3 个样品,由于该配方 Na 离子较多,导致玻璃结构网络外离子增多,此时氧化镨的添加会进一步增加网络外离子的数量,从而促进玻璃结构解聚,化学稳定性下降,该结果同拉曼和固态核磁分析结果一致。废物包容量为 10wt.% 条件下的3 个样品,随着氧化镨添加量的增加,Si、B、Na 浸出率逐步下降,显示废物包容量增加到 10wt.% 的情况下,氧化镨的添加促进玻璃结构化学稳定性增加。该测试结果同拉曼、固态核磁分析结果一致。随着废物氧化物和氧化镨的添加,玻璃网络中的氧含量增多会促进玻璃结构 Q4、Q3 占比的增加,同时氧化镨形成 PrOx 配合结构填充玻璃网络空隙,进一步增加玻璃结构的聚集性,从而导致玻璃结构聚集性和化学稳定性逐步提高。横向对比显示,废物包容量为 0wt. % 且氧化镨添加量 为 2wt. %、6wt.%、10wt.% 的 3 个玻璃样品(0P-1~3)的浸出率分别低于废物包容量为 10wt.% 且氧化镨添加量为 2wt.%、6wt.%、10wt.% 的 3 个玻璃样品( 10P- 1~3)的浸出率,表明废物包容量的增加会导致玻璃结构出现解聚,化学稳定性下降,可能是废物中大部分氧化物包括氧化镨都是充当玻璃结构中网 络调节剂所致。
4 总结
本文对不同废物包容量和氧化镨含量的高钠硼硅酸盐玻璃( 摩尔比为 SiO 2 ∶ B 2 O 3 ∶Na 2 O= 1 ∶ 0.23 ∶ 0.54 )样品进行分析研究,XRD 和 SEM/EDS 分析显示,废物包容量 10wt.% 条件下添加氧化镨 10wt.%,玻璃样品仍维持玻璃无定形结构,没有析晶相出现。拉曼和固态核磁分析显示,在废物添加量为 0wt.% 条件下,随着氧化镨的添加 Q4 和 Q3 占比下降,Q2 和 Q1 占比上升,玻璃结构有解聚趋势;在废物包容量 5wt.% 条件下,随着氧化镨的添加 Q4、Q3 和 Q 1 占比上升,Q2 占比下降;在废物包容量 10wt.% 条件下,随着氧化镨的添加 Q4、Q3 和 Q2 占比进一步上升,同时 Q1 占比出现下降,玻璃样品网络结构趋于聚集度增高。 PCT 测试结果显示,在废物包容量 0wt.% 条 件下,随着氧化镨的添加,化学稳定性下降;在废物包容量 10wt.% 条件下,随着氧化镨的添加,化学稳定性上升。化学稳定性 PCT 测试结果同玻璃结构分析结果较为一致。上述分析显示,在废物添加量为 0wt.% 条件下,氧化镨在玻璃结构中主要充当网络调节剂;当废物添加量增加到 5wt.% 和 10wt.% 时,玻璃结构随着氧化镨的添加玻璃网络空隙减少,玻璃网络结构聚集,因此在废物含量升高后氧化镨仍可能主要是充当网络调节剂,同时氧化镨对该玻璃结构和化学性质的影响主要是通过在网络中争夺氧,在玻璃结构空穴中形成 PrOx 结构,引起玻璃结构解聚或聚集,导致化学稳定性降低或增高。
参考文献:
[1] 罗上庚 . 放射性废物概论[M]. 北京 : 原子能出版社 , 2003.
[2] 罗上庚. 放射性废物处理与处置[M]. 北京: 中国环境科 学出版社, 2007.
[3] OJOVAN M I, LEE W E. An introduction to nuclear waste immobilisation[M]. 2nd ed. Amsterdam: Elsevier, 2014.
[4] 干福熹 . 硅酸盐玻璃物理性质变化规律及其计算方 法[M]. 北京: 科学出版社, 1966.
[5] 周艳艳, 张希艳. 玻璃化学[M]. 北京: 化学工业出版社, 2014.
[6] 张华, 贺诚, 常煚, 等 . 掺氧化钆对模拟动力堆高放废 液硼硅酸盐玻璃结构和化学稳定性影响研究[J]. 原子 能科学技术, 2023, 57(7): 1303-1311.ZHANG Hua, HE Cheng, CHANG Jiong, et al. Effect of gadolinium oxide on structure and chemical stability of borosilicate glass with simulated nuclear power plants HLLW[J]. Atomic Energy Science and Technology, 2023, 57(7): 1303-1311(in Chinese).
[7] 吴洋, 李文杰. 稀土氧化镨对氧化铝陶瓷微观结构的影 响[J]. 山东陶瓷, 2016, 39(3): 3-5.WU Yang, LI Wenjie. Effect of praseodymium oxide ad- ditive on microstructure of alumina ceramics[J]. Shan-dong Ceramics, 2016, 39(3): 3-5(in Chinese).
[8] 彭书杰. 氧化镨基陶瓷的微观结构及其非线性电学特 性研究[R]. 成都: 西南交通大学, 2013.
[9] C1285-14 Standard test methods for determining chem- ical durability of nuclear, hazardous, and mixed waste glasses and multiphase glass ceramics: The product con- sistency test (PCT), PA 19428-2959[S]. USA: ASTM In- ternational, 2014.
[10]MCMILLAN P. Structural studies of silicate glasses and melts—Applications and limitations of Raman spec- troscopy[J]. American Mineralogist, 1984, 69: 622-644.
[11]MYSEN B O, VIRGO D, SEIFERT F A. Relationships between properties and structure of aluminosilicate melts[J]. American Mineralogist, 1985, 70: 88-105.
[12]MANARA D, GRANDJEAN A, NEUVILLE D R. Ad- vances in understanding the structure of borosilicate glasses: A Raman spectroscopy study[J]. American Min- eralogist, 2009, 94(5/6): 777-784.
[13]TAN S, OJOVAN M I, HYATT N C, et al. MoO3 incor- poration in magnesium aluminosilicate glasses[J]. Jour- nal of Nuclear Materials, 2015, 458: 335-342.
[14]LI Q, LI Z, HE C, et al. Understanding the solubility and crystallization of molybdenum in high-sodium borosili- cate glasses: Effect of lanthanum oxide[J]. Journal of Ra- dioanalytical and Nuclear Chemistry, 2022, 331(5): 2105- 2115.
[15]ZHOU J, LIAO Q, WANG F, et al. Effect of Na2O and CaO on the solubility and crystallization of Mo in borosilicate glasses[J]. Journal of Non-Crystalline Solids, 2021, 557: 120623.
[16]MAEKAWA H, MAEKAWA T, KAWAMURA K, et al. The structural groups of alkali silicate glasses determined from 29Si MAS-NMR[J]. Journal of Non-Crystalline Solids, 1991, 127(1): 53-64.
[17]XIE J, TANG H, WANG J, et al. Network connectivity and properties of non-alkali aluminoborosilicate glasses [J]. Journal of Non-Crystalline Solids, 2018, 481: 403- 408.
[18]KIELPINSKI A L. Applications of atomistic simulation to radioactive and hazardous waste glass formulation de- velopment[C]//Waste Management’95. USA: Estinghouse Savannah River Co., 1995.
申明:该文章仅用于学术交流,若侵害本文作者权益,请联系网站负责人进行删除,谢谢!
管理员
该内容暂无评论