联系人:沈经理
手 机:16602150044
电 话:400-663-2276
地 址:上海市嘉定区华江公路688号凯迪大厦210室
(来源:期刊-《东北大学学报 》- 第38卷第4期)
薛首峰,吴文远,边 雪
( 东北大学 冶金学院,辽宁 沈阳 110819)
摘 要 : 以 TbCl3 气溶胶为前驱体,在微纳米尺度研究了 TbCl3 在空气氛围中的高温热解机理,用 XRD和 FESEM 分别表征了热解产物的物相组成和微观形貌。基于实验结果和热力学分析,讨论了 TbCl3 气溶胶热 解生成 TbO2 的化学反应机理,以及促进 TbCl3 热解转变为氧化铽的动力学原因。研究结果表明: TbCl3 气溶胶 在空气氛围中热解可生成具有化学计量比形式的氧化物 TbO2 ,当热解温度高于 800 ℃ 时,热解产物为非化学 计量比形式的 Tb7 O12 ,没有发现 TbOCl 物相 ; 在气溶胶热解产物中可以观察到更多热解中间产物,从而对 TbCl3 的性质和热解过程的认识更充分。
关 键 词 : TbCl3 ; 气溶胶 ; 热解 ; 机理 ; Tb(OH) 2 Cl ; TbO2
中图分类号 : TF 845. 6 文献标志码 : A 文章编号 : 1005-3026(2018) 10 -1423-05
稀土元素由于其特殊的物理化学性质引起了广泛关注[1],研究表明稀土元素铽在 CO 催化氧化、发光材料和水解制氢等多个领域表现出优异性能[2- 4],因此对于铽的研究有着重要的理论及现实意义。无水氯化铽是熔盐电解制备金属铽的主要原料[5],由于具有较强的吸水性,氯化铽通常以水合物的形式存在[6],因此国内外学者曾使用不同方法对水合氯化铽的脱水过程进行了相关研究[7- 9],然而关于氯化铽在空气氛围中的高温热解机理尚未见报道。
气溶胶热解法被广泛用于制备粉体材料[10 -11],其特点是在超声波的作用下将溶液雾化 为粒径约小于 5 μm 的气溶胶,由载气带入高温炉发生热解反应,制备出分散性好的、形貌规则的超细粉体[12]。为了研究氯化铽在微纳米尺度范围的热解行为,本文选择以氯化铽气溶胶为前驱体,在 600 ~1 100 ℃ 的范围内研究了氯化铽的高温热解反应过程,结合热力学理论分析初步探讨了氯化铽的高温热解机理。
1 实验材料和方法
氧化铽(Tb4 O7 ) 的质量分数为 99. 99% ,江苏国盛稀土有限公司生产 ; 双氧水,分析纯,成都市科龙化工试剂厂生产 ; 乙醇,分析纯,国家药品化学试剂有限责任公司生产。实验中所用氯化铽 (TbCl3 ·6H2 O) 通过氧化铽与盐酸反应后重结晶制得。
准确称取一定量的氯化铽,将其溶解到 200mL 的蒸馏水中得到的溶液浓度约为0. 05mol / L。将配制好的溶液移入雾化器,将雾化器与温度恒定的高温管式炉相连,调整载气流速约为10 L / min,打开雾化器即可进行实验。待实验结束后在管式炉的末端收集热解产物。高温炉温度由程序控温仪精确控制。
用 XRD ( PANalytical X ’Pert Powder) 分析产物物相,用场发射扫描电镜 ( FESEM ,Hitachi S-4800) 表征产物形貌。
2 结果与讨论
2. 1 热解产物的物相组成
图 1 为 TbCl3 气溶胶在 600 ~1 100 ℃ 热解产物的 XRD 结果。600 ℃ 时 TbCl3 气溶胶所得热解产物的衍射花样( 图 1a) 中 2θ 角为 29. 6 ° ,34. 3 °, 49. 4 °和 58. 6 °的衍射峰与 PDF 卡片 75-0209 相一致,说明有 TbO2 生成。但 2θ 角为 14. 2 °, 16. 9 °,24. 2 °和 37. 6 °的衍射峰在 ICSD 晶体学数据库没有找到与其相匹配的含铽无机化合物的 PDF 卡片,说明在 TbCl3 气溶胶热解时有其他中间物相 TbX 形成。700 ℃ 时热解产物的主要物相为 TbO2 ,次要物相为 TbX ( 图 1b) 。800 ℃ 时热解产物中出现了两种不同形式的氧化铽即 TbO2 和 Tb7 O 12 ( 图 1c) ; 热解温度为 900 ~ 1 100 ℃ 时,热解产物为 Tb7 O 12和微量的 TbX 物相( 图 1d) 。
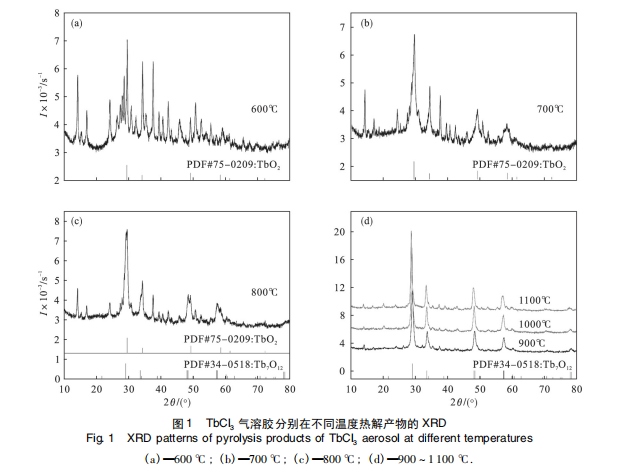
通常认为 TbCl3 热解时首先发生水解反应,生成 TbOCl,有趣的是 TbCl3 气溶胶的热解产物中并没有发现 TbOCl 物相。随着热解温度的升高,热解产物中氧化铽的含量逐渐增多,与此同时,热解过程中形成的中间物相 TbX 的衍射峰强度逐渐减小,说明中间物相 TbX 随着热解温度的升高逐渐转变为氧化铽。
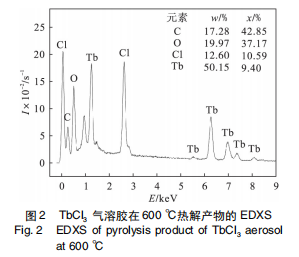
图 2 为使用 FESEM 配置的 EDXS 对 600 ℃ 时 TbCl3 气溶胶热解产物的元素分析结果,在产物中共检测到了 C,Tb,O 和 Cl 四种元素。其中 C 是由于导电胶所致。Cl 与 Tb 的原子比约为 1.13 ,接近于 1 ; O 与 Tb 的原子比约为 3. 95,接近于 4。XRD 分析表明热解产物中没有 TbCl3 和 TbOCl, 热解产物中的 O 含量较高说明热解中间产物 TbX 中含有 O 元素。在 600 ~ 1 100 ℃ 范围内 TbCl3 气溶胶的热解产物中始终存在中间产物 TbX。由于镧系收缩效应,元素性质非常相似,其中 Pr 元素与 Tb 元素的物理化学性质极其相似, 形成的稳定氧化物均以非化学计量比形式存在。 PrCl3 气溶胶热解机理研究表明[13] : 在 600 ℃ 时热解产物主要是 Pr(OH) 2 Cl 和 PrOCl,随着温度的升高,热解产物中 PrOCl 和 PrO2 的含量逐渐增加,温度高于 900 ℃ 时 PrOCl 转化为 PrO2 的速度增大,热解产物中PrO2 的含量明显增多,但是PrCl3 气溶胶在 1 100 ℃ 的热解产物中只有PrO2 和 Pr(OH) 2 Cl 两种物相存在,而没有发现 PrOCl 相.TbCl3 气溶胶热解呈现出相似的规律,即中间产物 TbX 在 600 ~ 1 100 ℃ 范围内始终存在,且 TbCl3 气溶胶在 1 100 ℃ 的热解产物中也只含有 Tb7 O12和中间产物 TbX ; 由于镧系收缩效应的存在,镧系原子半径大小相差不大,因此镧系元素可形成晶体结构相同的化合物。据此推断,TbCl3 气溶胶热解时形成的中间产物可能是Tb(OH) 2 Cl。
2.2 TbCl3 气溶胶的热解机理
稀土氯化物热解过程中易发生水解反应,生成氯氧化物,其在更高的温度将被氧化为稀土氧化物。然而 TbCl3 气溶胶热解产物中没有发现 TbOCl 物相。因此,有必要对 TbCl3 气溶胶的高温热解机理进行探讨。
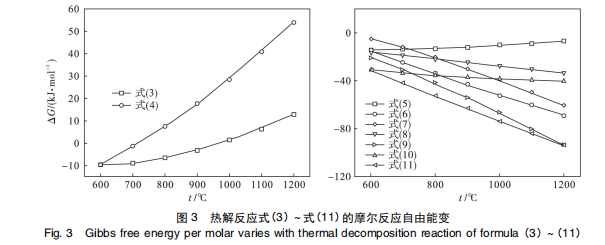
根据化学反应的物质守恒定理及 TbCl3 气溶胶在 600 ~1 100 ℃ 时热解产物的物相组成,TbCl3 气溶胶可能发生的热解反应如式(1) ~式(11) 所述。图 3 为热解反应式(3) ~ 式(11) 的摩尔反应吉布斯自由能变,由于缺乏 Tb(OH) 2 Cl 的热力学数据,暂无法得到热解反应式(1) 和式(2) 的摩尔反应吉布斯自由能变。600℃ 时热解产物为 Tb(OH) 2 Cl,因而 Tb(OH)2 Cl 需通过一步脱水反应热解生成 TbOCl。由此可知,TbCl3 的热解首先发生水解反应,生成 Tb ( OH) 2 Cl,如式 ( 1 ) 所示, Tb(OH) 2 Cl 热解脱水生成 TbOCl,如式(2) 所示。图 3a 中式(3) 和式(4) 的 ΔG 大于-10 kJ / mol,并且随着温度的升高而增大,说明在高温条件下,化学反应式(3) 和式 (4 ) 不能向右自发进行,即 TbCl3 高温热解时不能通过一步反应直接转变为 TbOCl。图 3b 为热解反应式 ( 5 ) ~ 式( 11 )在 600 ~1 200 ℃ 范围内的 ΔG,其中反应式(5) ~式 (7) 为 TbCl3 热解时生成 TbO2 时可能的反应。由 3b 可知,ΔG(5) 随着温度的升高逐渐增大 : 当反应过程中有 H2 O 参与反应,热解温度高于 700 ℃ 时 ΔG(6) <-20 kJ / mol,并且随着温度的升高而减小 ; ΔG(7) 随着温度的升高也逐渐减小,而且 ΔG(7) >ΔG(6) ,由此可见 H2 O 对 TbCl3 热解转化为 TbO2 有着重要作用 : H2 O 的存在使得 TbCl3 在较低的温度热解时,首先发生水解反应,生成中间物相Tb(OH) 2 Cl,降低 TbCl3 转变化 TbOCl 的活化能,使 TbCl3 在高温热解时更易被氧化为 TbO2 ; 另一方面,H2 O 的存在促进了 TbCl3 的热解。反应式(8) ~式 ( 11) 为热解温度高于 900 ℃ 时,TbCl3 热解生成 Tb7 O12 可能发生的反应。由图 3b 可知热解反应式(8) ~式 ( 11) 的 ΔG 均小于 零,ΔG(8) 与 ΔG( 10) 在 600 ~1 200 ℃ 范围内随着温度的升高变化不大,但是 ΔG(9) 与 ΔG ( 11) 随着温度的升高快速减 小,说明当温度高于 900 ℃ 时, TbCl3 热解按照式(9) 与式 (11) 的方式向右进行的趋势显著增强,式(11) 说明 H2 O 的存在有利于 TbCl3 热解生成 Tb7 O12 。
TbCl3 + 2H2 O = Tb(OH) 2 Cl + 2HCl , (1)
Tb(OH) 2 Cl = TbOCl + H2 O , (2)
TbCl3 + H2 O = TbOCl + 2HCl , (3)
2TbCl3 + O2 = 2TbOCl + 2Cl2 , (4)
2TbCl3 + 2O2 = 2TbO2 + 3Cl2 , (5)
4TbCl3 + O2 + 6H2 O = 4TbO2 + 12HCl , (6)
2TbOCl + O2 = 2TbO2 + Cl2 , (7)
7TbO2 = Tb7 O12 + O2 , (8)
14TbOCl + 5O2 = 2Tb7 O12 + 7Cl2 , (9)
14TbCl3 + 12O2 = 2Tb7 O12 + 21Cl2 , (10)
28TbCl3 + 3O2 + 42H2 O = 4Tb7 O12 + 84HCl . (11)
综上所述,TbCl3 气溶胶热解时首先发生水解反应,生成 Tb ( OH)2 Cl,如式 ( 1) 所示,温度升高 Tb(OH)2 Cl 脱水生成 TbOCl,如式(2) 所示 ; 在 600 ~ 800 ℃ 时,TbOCl 氧化生成 TbO2 ; 热解温度高于 900 ℃ 时,由 Tb(OH)2 Cl 脱水形成的 TbOCl 氧化生成 Tb7 O12 ,如式(9) 所示。
2. 3 热解产物的微观形貌表征
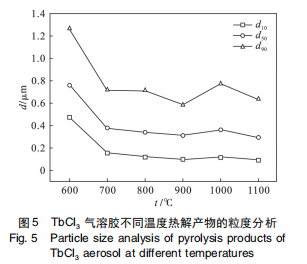
以气溶胶为前驱体时,TbCl3 热解生成具有化学计量比形式的氧化物 TbO2 ,这可能与气溶胶本身及其热解过程的特点相关。由图 4 可知 TbCl3 气溶胶热解产物为规则的球形颗粒。图 4a 内嵌的高倍扫描电镜图片显示球形颗粒大小约为 50 nm,气溶胶热解生成的球形颗粒直径约为 0. 1 ~ 1. 3μm,d50 约为 0. 5μm( 图 5) 。

2. 4 TbCl3 气溶胶热解过程
在超声波作用下 TbCl3 溶液雾化形成 TbCl3 气溶胶液滴,其随载气进入管式炉。TbCl3 气溶胶进入管式炉后,首先在液滴的表面发生水分的快速蒸发导致液滴内溶质浓度快速达到过饱和状态,使溶质以 TbCl3 ·xH2 O ( 1 ≤x ≤6) 的形式从液滴析出,完成液相到固相的转变。由于受限于气溶胶液滴形状,TbCl3 ·xH2 O 晶粒从气溶胶液滴中析出后形成了球形颗粒,气溶胶液滴相当于一个承载了 TbCl3 的软模板。由图 4 可知,以 TbCl3 气溶胶液滴为前驱体,在高温下水分蒸发后得到了 TbCl3 ·xH2 O 纳米颗粒组成的微米级球形颗粒,因此可认为 TbCl3 的热解是在微米~纳米尺度的范围内完成.热解产物中 TbO2 的生成可能与形成 的TbCl3 ·xH2 O 微纳米球形颗粒紧密相关,由于粒径的尺寸效应: ①颗粒具有较大的比表面积,提高了热解过程气体的传质速率 ; ②热解反应与温度密切相关,在颗粒的径向上温度的分布相对于宏观块体颗粒更均匀,因此在球形颗粒粒径的径向上热解反应同时进行 ; ③TbCl3 气溶胶液滴由流速约为10 L / min 的载气送入管式炉,气溶胶液滴在管式炉中的停留时间≤ 1 s ; 由于热解产物在高温区停留时间短,生成的 TbO2 来不及转化为其他形式的氧化铽,因此以 TbCl3 气溶胶为前驱体热解时,在热解产物中存在具有化学计量比形式的氧化铽 TbO2 。
3 结 论
1) 以氯化铽气溶胶为前驱体,氯化铽在微纳米尺度范围内热解时极易氧化生成氧化铽。
2) 氯化铽热解时首先发生水解反应,生成 Tb( OH) 2 Cl,其脱除一分子水后形成 TbOCl,相应的化学反应为 TbCl3 + 2H2 O = Tb ( OH ) 2 Cl + 2HCl,Tb( OH) 2 Cl = TbOCl + H2 O。
3) 以氯化铽气溶胶为前驱体时,热解反应发生在微米~纳米的尺度范围内。当热解温度低于 800 ℃ 时,热解产物中存在 TbO2 和 Tb7 O12 ,当热解温度高于 800 ℃ 时,产物中的氧化铽为 Tb7 O12.。
4) 氯化铽气溶胶高温热解时生成氧化铽存在两种反应途径 : 一种为先氧化生成 TbO2 ,其在高温下脱氧生成 Tb7 O12 : 2TbOCl + O2 = 2TbO2 + Cl2 ,7TbO2 = Tb7 O12 + O2 ; 另一种反应途径,由于 TbO2 热稳定性差,因此热解生成的 TbOCl 在高温下直接氧化为 Tb7 O12 ,即 14TbOCl + 5O2 = 2Tb7 O12 + 7Cl2 。
参考文献 :
[1] Wang R G,Sama V,Li D Q,et al.Hydrothermal synthesis of rare-earth oxide nanocatalysts for automotive exhaust clean-up [J].Advanced Materials Research ,2012 ,512 ( 515 ) : 1624 -1629.
[2] Dabboussi S,Elhouichet H,Bouzidi C,et al.Excitation and emission processes of Tb3 + in porous anodic alumina [J]. Applied Surface Science,2009,255 (7) :4255-4258.
[3] Devaiah D,Jampaiah D,Saikia P,et al.Structure dependent catalytic activity of Ce0.8 Tb0.2 O2 - δ and TiO2 supported Ce0.8 Tb0.2 O2 - δ solid solutions for CO oxidation [J].Journal of Industrial and Engineering Chemistry,2014,20 ( 2 ) : 444 - 453.
[4] Bhosale R,Kumar A ,Almomani F. Solar thermochemical hydrogen production via terbium oxide based redox reactions [J].International Journal of Photoenergy,2016,2016 ( 1 ) : 1-9.
[5] Li M,Gu Q,Han W,et al.Electrodeposition of Tb on Mo and Al electrodes: thermodynamic properties of TbCl3 and TbAl2 in the LiCl-KCl eutectic melts [J].Electrochimica ACTA,2015, 167 ( 1) : 139 -146.
[6] Gschneidner K A,Eyring L,Lander G H.Handbook on the physics and chemistry of rare earths [M].Amsterdam : Elsevier,2002 : 100 -130.
[7] Johan-Sundstrijm O W. Investigation of the dehydration schemes of NdCl3 · 6H2 O,TbCl3 · 6H2 O and DyCl3 · 6H2 O using a fluidized bed [J].Journal of Alloys and Compounds, 1997,249( 1 /2) : 224-228.
[8] Van Hong V,Sundstr![]() m J.The dehydration schemes of rare- earth chlorides [J].Thermochimica ACTA.1997,307 ( 1 ) : 37-43.
m J.The dehydration schemes of rare- earth chlorides [J].Thermochimica ACTA.1997,307 ( 1 ) : 37-43.
[9] 苏勉曾,李根.稀土元素氯化物水合物的脱水过程与水解 反应的机理[J].化学通报,1979,43 (4) : 34-38.
( Su Mian-zeng ,Li Gen. Mechanism of dehydration and hydrolysis of rare earth chloride hydrates [J].Chemistry Online,1979,43 (4) : 34-38.)
[10] Vestli M,Maide M,Nurk G,et al.Characterization of doped ceria films as SOFC electrolyte prepared by using ultrasonic spray pyrolysis method [J].ECS Transactions,2013,57 ( 1 ) : 1159 -1165.
[11] 吴文远,薛首峰,边雪,等.超细氧化铈制备工艺研究[J]. 东北大学学报( 自然科学版) ,2015,36(6) :800-804.
(Wu Wen-yuan,Xue Shou-feng,Bian Xue,et al.Study on the preparation process for CeO2 superfine powder[J].Journal of Northeastern University ( Nature Science) ,2015,36 ( 6 ) : 800 - 804.)
[12] Goulart C,Djurado E.Synthesis and sintering of Gd-doped CeO2 nanopowders prepared by ultrasonic spray pyrolysis [J]. Journal of the European Ceramic Society,2013,33 ( 4 ) : 769 - 778.
[13] 薛首峰,吴文远,边雪,等.氯化镨气溶胶的高温热解机制 研究[J].稀有金属,2018,42(6) : 640-649.
(Xue Shou-feng,Wu Wen-yuan,Bian Xue,et al.Mechanism of thermal decomposition of PrCl3 aerosol at high temperature in air atmosphere[J].Chinese Journal of Rare Metals,2018,42 (6) : 640-649.)
申明:该文章仅用于学术交流,若侵害本文作者权益,请联系网站负责人进行删除,谢谢!
管理员
该内容暂无评论