联系人:沈经理
手 机:16602150044
电 话:400-663-2276
地 址:上海市嘉定区华江公路688号凯迪大厦210室
(来源:期刊-《山东陶瓷 》- 第46卷第2期)
周斌1 , 王鹏2 , 孟凡鹏3 , 张孝贤4 , 张学谦5 , 王依山6
(1 . 山东理工大学材料科学与工程学院,2638188396@ qq.com;
2. 山东理工大学材料科学与工程学院,wangpeng.365@ 163 . com;
3 . 山东硅元新型材料股份有限公司,mengfanpeng@ sicer. com;
4. 山东理工大学材料科学与工程学院,1174850132@ qq.com;
5 . 山东理工大学材料科学与工程学院,zhangxueqian@ sdut. edu. cn;
6. 通信作者,山东理工大学材料科学与工程学院,wyslg@ sdut. edu. cn)
摘 要:氧化铈催化剂已经在催化领域被广泛研究与应用。本文讨论了氧化铈的合成技术对形貌、尺寸与性能的影响,通过不同温度与碱浓度制备的三种不同形貌的氧化铈来探讨形貌对催化活性的影响。不同的二氧化铈纳米形貌表面氧缺陷浓度的变化被认为与晶体层选择性暴露在不同纳米结构中有关,催化活性顺序为:棒>立方体>颗粒。CeO2 的形貌不仅对纯 CeO2 催化剂的催化性能具有巨大影响,对铈负载催化剂也具有很大影响,但氧化铈形貌对铈负载催化剂的催化行为是特定于情况的。不同的负载物与不同的氧化铈形貌复合后的催化性能主要由活性位点,表面氧空位,金属-载体相互作用、污染物降解过程等多方面共同决定。本文还介绍了氧化铈复合催化剂在臭氧催化、催化降解挥发性有机物及光催化领域的优势与进展。
关键词:氧化铈;催化剂;纳米形貌;臭氧催化
铈是地球上第 25 丰富的元素,主要存在形式是氧化铈( IV) ,也称为二氧化铈 。这种晶体材料由于其独特的性质和广泛的应用而受到广泛关注 。氧化铈是一种著名的稀土材料,具有非常理想的化学和物理性能[1] 。它具有高氧气储存容量和高离子电导率、高介电常数,在可见光和近红外区域显示出高透明度,同时是一种高效的紫外线吸收剂 。除了常用于陶瓷制造外,氧化铈还作为促进剂和载体材料在催化反应中发挥着关键作用[2] 。氧化铈的不同应用与其独特的性质密切相关,而这反过来又归因于其结构 。 由于离子的传输特性,氧化铈微观结构呈现出不同的氧阴离子和铈阳离子环境 。二氧化铈的理论和实验研究表明,其很容易从 CeO2 还原为 CeO2-x 。它在低氧分压和升高的温度下释放大量的氧气,导致混合离子电子导电性 。氧化铈中的电子可以被认为是通过晶格内的热激活跳跃过程移动的小极化子,因此载流子和传输特性(如氧原子在晶体中的移动)在很大程度上取决于移动空位浓度 。氧化铈的储氧能力基于 Ce4+ 和 Ce3+ 之间的氧化还原行为、不稳定氧空位的容易形成以及体氧物种的相对高迁移率[3] 。由于其高的储氧能力,氧化铈被研究用于多相催化,可以提供活性氧物种以确保催化反应。 CeO2 通过氧化还原反应进行储氧,Ce3+ 增加了不稳定表面氧空穴和氧自由基的数量;然而,纯CeO2 催化剂性能较差,因此许多研究人员集中于通过添加不同的金属氧化物,合成不同的复合催化剂,使铈基催化剂的性能不断优化以提高催化性能 。本文主要介绍氧化铈的制备、性质及氧化铈基催化剂在水中污染物、挥发性污染物的催化降解和光催化领域中的所起到的作用。
1 氧化铈制备
纳米材料的合成技术是改变其性能的主要原因之一 [4] 。在合成过程中有着许多因素可以 对纳米材料的结构和尺寸产生重要影响,因此纳米材料在各个领域中的应用也会出现不同的变 化 。氧化铈纳米材料有多种合成方法,包括沉淀法 [5] 、共沉淀[6] 、水热[7] 、机械合成[8] 、燃烧合成 [9] 溶胶-凝胶[10] 、微乳液[11] 、和热解[12] 等,其中主要使用的合成方法为沉淀法和水热法。
在沉淀法和共沉淀法中,研究发现主要影响因素是:(1) 煅烧温度和时间;(2) 添加表面活性剂和表面活性剂类型;( 3 ) 老化时间和合成温度 [13- 14] ;然而,这些因素都需要有很好的控制, 否则合成出的纳米材料形状将会发生变化,性能也随之降低。
水热法被认为是最简单经济和无添加剂的方法,然而,水热法的主要挑战在于对纳米形态的控制,需要仔细调整以控制其特性 。在水热合成过程中,碱浓度和温度处理是决定最终纳米形貌的关键因素[15] ;此外,水热合成所用的设置和条件具有多样性,导致难以将确定的条件与形态结构联系起来。
Laura 等[16] 通过水热处理并改变 NaOH 浓度范围( 1 ~ 15 mol/L) 以确定形态相图( 图 1) 。 在低温( <100 ℃ ) 且碱浓度低于 10 mol/L 时,未观察到二氧化铈纳米棒的形成,二氧化铈纳米颗粒的尺寸大于 5 nm 。在低温(70 ℃ ) 时形成约 7 nm , 长度在 20 ~ 80 nm 范围的纳米颗粒 。在 1 mol/L 的低碱浓度,温度升高至 100 ℃ 时观察到二氧化铈纳米棒( 长度 20 ~ 70 nm ) 的形成,存在纳米颗粒( < 5 nm ) 。在 100 ℃ 的恒定合成温度下,碱浓度的增加有利于纳米棒的形成,不利于纳米颗粒的形成。
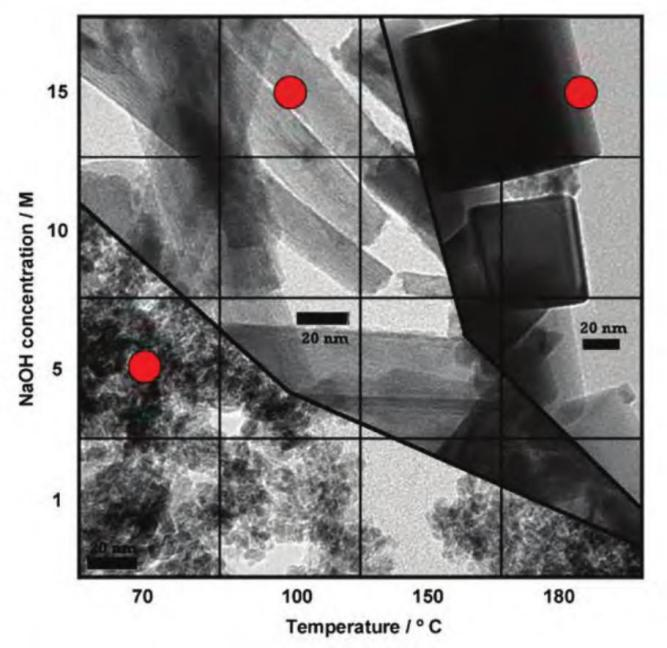

在 150 ℃ 的温度下,二氧化铈纳米棒在所有的碱浓度范围内都有形成 。在低 NaOH 浓度( 1 mol/L) 下,观察到二氧化铈纳米颗粒与纳米棒的共存 。在高碱浓度( 15 mol/L) 下,观察到二氧化铈纳米立方体的形成 。将水热温度提高到 180 ℃ 有利于主要形成纳米立方体 。在低碱浓度( <5 mol/L) 下,纳米立方体、纳米棒和纳米颗 粒结构共存。
纳米棒的直径和长度随着水热合成过程中使用的温度和碱浓度的增加而增加 。在 70 ℃ 和碱浓度为 10 mol/L 时,平均直径为 7 nm , 长度为 20 ~ 80 nm 。在 150 ℃ 和碱浓度为 15 mol/L 时,平均直径为 40 ~ 60 nm , 长度为几微米。
这三种纳米结构的形成机理为:在低温和低碱浓度下,溶解/再结晶速率较慢,导致从溶液中最初形成的各向异性 Ce( OH)3 核形成二氧化铈纳米颗粒 。 当温度或碱浓度增加时,驱动 Ce(OH) 3 核各向异性生长的化学势更高,形成二氧化铈纳米棒 。在更高的温度和碱浓度下,Ce( OH)3 核被氧化为具有纳米立方体形态的二氧化铈。
2 氧化铈性质
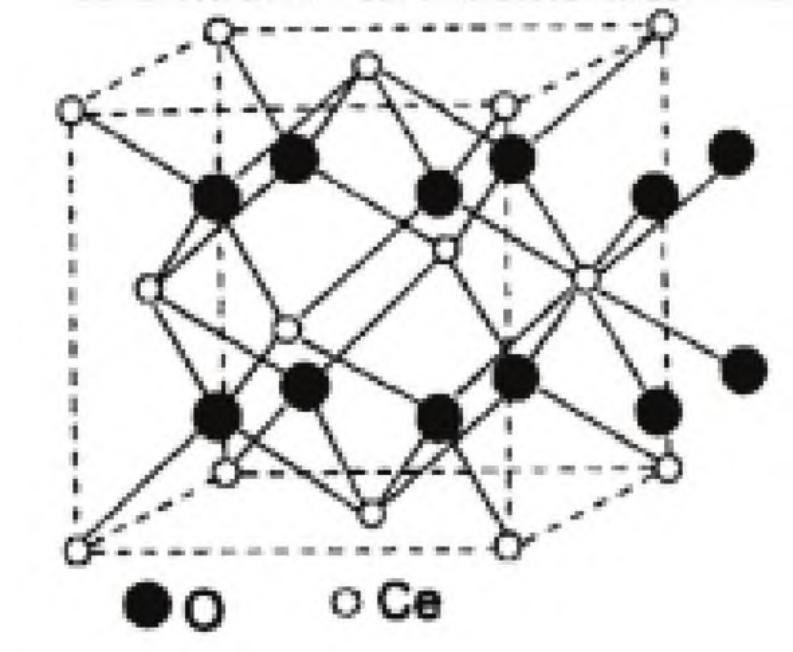
CeO2 晶体结构见图 2 。可以通过取代阳离子亚晶格上的低价元素来适应高氧缺乏 。它在高温和低氧分压下释放大量的氧气 。氧空位缺陷增强了二氧化铈的电子和化学性能 。 由于晶格中氧的减少,捕获在两个铈位点的两个电子将 Ce4+ 转化为 Ce3+ 离子,指向其可还原性质 。铈基催化剂多相催化的理论研究表明,铈的还原意味着窄带形式 4f 电子的产生和 Ce3+ 离子的伴随存在。CeO2 表面上近表面氧空位上的缺陷形成导致过量电子定位在下一个最近的 Ce 离子上,而不是最近的阳离子位置 。较高浓度的氧空位使氧原子在晶体内的移动变得容易,这有利于其表面的氧化还原反应,从而产生优异的催化活性[17] 。
CeO 2 表面晶格的三个主要低折射率面是 ( 111 ) 、( 110 ) 和( 100 ) 。 由于每个平面中阴离子和阳离子的化学计量平衡,CeO 2 ( 110 ) 表面具有零电荷 。CeO 2 ( 111 ) 是平面带电的表面, 重复单元由对称配置的三个平面组成,因此在垂直于表面的方向上没有净偶极矩 。 CeO 2 ( 100 ) 表面具有交替带电的平面,重复单元只有两个平面,产生垂直于表面的偶极矩。 三个平面的稳定性遵循顺序 ( 111 ) > ( 110 ) > ( 100 ) , 活性相反。
不同的二氧化铈纳米形貌表面氧缺陷浓度的变化被认为与晶体层选择性暴露在不同纳米 结构中有关。CeO2 纳米棒和纳米立方体的表面上观察到每单位表面积更高的催化活性,他们的 暴露面分别为 ( 110) 和 ( 100) 平面与 ( 100) 平面 。计算机模拟表明,低指数( 111) 表面具有最低的表面能,因此是最稳定的表面[18] 。类似地, Conesa 等[19] 指出,在( 110) 和( 100) 上形成氧空位所需的能量小于在 ( 111 ) 上形成的能量。 CeO2 纳米颗粒主要暴露面为的稳定(111) 平面,而棒状纳米结构优先暴露面为(110) 和(100) 平面,为 CO 氧化提供更高的储氧能力和催化活性 。在另一项工作中,Zhou 等 [20] 表明,具有明确定义的反应平面[ ( 001) 和( 110) ] 的 CeO2 纳米棒显示出比 CeO2 纳米颗粒更高的 CO 氧化活性,因为它们的反应平面更 多 。 因此,纳 米 棒 [以(110) 和( 100) 为主要暴露平面]是活性最高的催化剂,其次是纳米立方体[ 以( 100) 为主要暴露平面],纳米颗粒[以(111) 为主要暴露平面]呈现最低的活性。
3 氧化铈改性
二氧化铈的独特性质可以通过使用几种方法进行修饰来增强 。一种方法是在二氧化铈晶格中掺杂具有较低价或较小尺寸的其他金属离子,这种方法不仅可以改善所涉及的金属氧化物的性能,而且可以形成具有新颖物理和化学性质的新的稳定材料 。将金属/金属氧化物掺入二氧化铈晶格形成复合氧化物[21] , 将掺杂剂引入二氧化铈晶格可以根据几个因素改变二氧化铈的储氧行为,包括金属阳离子掺杂剂的性质和组成、所得结构的稳定性、晶体结构的变化、Ce4+ - Ce3+ 转变的容易程度、载流子(氧空位)浓度以及表面特性如表面积和孔隙率 。另一种方法是将氧化铈或其掺杂的类似物分散在合适的载体材料上,如活性炭、石墨烯等 。氧化铈也可以作为金、铂、钯等金属分散的载体[22] 。
对二氧化铈基材料的改性主要使用过渡金属、稀有碱金属/碱土金属、稀土金属和贵金属, 这些金属具有更好的活性和热稳定性 。离子半径与类 Ce3+/4+ 稀土阳离子离子半径略有不同的 掺杂剂形成固溶体,从而扭曲 CeO2 晶格,导致大量的氧空位缺陷,从而提高二氧化铈的储氧能力和氧化还原性能[23] 。碱金属和碱土金属的高迁移率增强了二氧化铈基氧化物的催化活性[24] 。 贵金属表现出弱金属氧键,与氧化铈结合时表现出更大的催化活性[25- 26] 。
4 氧化铈及其复合催化剂的应用
4. 1 氧化铈不同形貌的应用
CeO2 由于其独特的氧化还原行为和高储氧能力,已被广泛应用于催化氧化的各个方面 。 由 于 CeO2 的形貌对 CeO2 催化剂的催化性能的影响巨大,人们对 CeO2 的形态调控越来越感兴趣。
Laura 等[16] 报告了三种氧化铈形貌相图的测定,该相图将碱浓度和水热处理温度的影响与 最终的 CeO2 纳米结构形态联系起来 。为了将 CeO2 的物理化学性质与其催化氧化活性相关联,对具有代表性的形状( 纳米颗粒、纳米棒和纳米立方体)进行了全氧化测试,结果表明催化活性与 Ce3+/Ce4+ 比率和表面氧空位浓度直接相关,催化活性顺序为:棒>立方体>颗粒 。Wei 等 [27] 合成了三种不同载体形貌的 Pt/CeO2 催化剂(棒状(CeO2-R) 、立方体( CeO2-C) 和八面体 (CeO2-O) , 特别适用于低温催化氧化C2 H4 。所制备的催化剂表现出较强的形状依赖性催化活性,依次为 Pt/CeO2 - O > Pt/CeO2 - C > Pt/CeO2 - R 。这种独特的性能主要归因于 Pt/CeO2 催化剂活化的氧物种变化相关的 C2 H4 氧化的不同步骤 。在三种催化剂中,Pt/CeO2 - O 中间物质积累问题最小,低温 C2 H4 催化氧化活性最高。
Bian 等[28] 制备了一系列具有棒状、立方体、颗粒和八面体形态的 CeO2 纳米材料,发现负载在 CeO2 纳米颗粒(5Ni/NPs) 上的催化剂表现出比具有其他形态 CeO2 载体的催化剂高得多的催化活性和更好的稳定性 。5Ni/NPs 催化剂的优异性能归因于 5Ni/NPs 催化剂上丰富的表面氧空位、丰富的中等强度表面碱性位点和适度的金属-载体相互作用,此外,镍的独特配位环境和适度的金属-载体相互作用可以抑制金属镍活性位点的热烧结 。这项工作确认了具有暴露的 (111) 晶面的 NPs 形态中的 CeO2 可以作为镍基催化剂的优良载体,具有优异的 CO2 甲烷化低温催化性能。
显然,铈负载催化剂在氧化铈形态方面的催化行为是特定于情况的 。不同的负载物与不同 的氧化铈形貌之间存在不同的协同作用,负载后所表现的催化性能也不同,同单独氧化铈形貌所 表现的催化性能存在较大差异。
4.2 催化降解水中污染物
臭氧由于其强大的氧化能力而在水处理技 术中得到广泛利用( 图 3) , 但由于其与有机污染物反应的固有选择性,臭氧在化学需氧量 ( COD) 高的废水中的使用有限 。该方法还需要复杂的设备,导致较高的操作成本 。催化剂的加入有望改善分子臭氧的分解,以生成高活性自由基,促进有机物的有效矿化 。各种金属、金属氧化物、活性炭和矿物被用作催化剂以提高污染物去除效率,催化剂的加入可进一步提高了臭氧利用效率[29] 。氧化铈被认定可用于有效去除选定有机化合物的臭氧氧化催化剂。
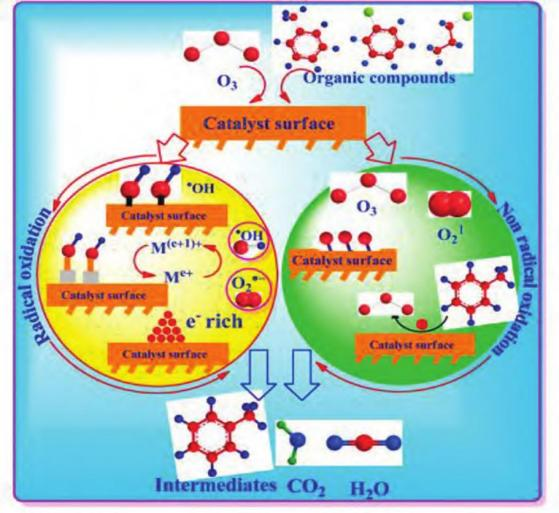

Xiao 等[30] 发现 Pt 纳米粒子与 CeO2 在催化剂表面紧密接触,并发生强烈的相互作用 。 由于 Pt 纳米颗粒( NPS) 与 CeO2 之间存在很强的相互作用,Pt 纳米粒子与 CeO2 之间的强相互作用增加了氧空位的数量,从而提高了臭氧分解活性, 产生了更多的活性氧,有助于甲苯氧化 。张兰河等 [31] 制成掺杂型 CeO2/Al2 O3 催化剂 。该催化剂中主要的活性物质为CeO2 , 掺杂的金属氧化物为有机物和 O3 的反应提供了反应空间,O3 在催化剂上被吸附后产生了氧化性更强的 · OH , 去除有机物的反应由直接臭氧化为主转变为间接臭氧化为主,CeO2/Al2 O3 催化性能更高,催化剂表面的活性位点增加 。Roy 等[32] 通过在负载二氧化铈的介孔 SiO2 上过量溶液浸渍 Ru 和 Fe3 O4 纳米颗粒,合成了 Ru-Fe3 O4/CeOx-SiO2 ( Ce3+/ Ce4+ , x = 1 .64) , 二氧化硅的高表面积和大介孔促进了活性催化位点和氧空位的精细分散。
He 等 [33] 分析了不同合成条件下制备的 CeO2-MnO2 复合金属氧化物催化剂 。吸附实验表明,获得的 CeO2-MnO2 复合金属氧化物催化剂对 NH4 +-N 的吸附影响很小,证实了在 Ce/ MnO x 复合金属氧化物催化剂上 NH4 +-N 的催化臭氧化中起重要作用的新相MnO2 ;此外,NH4 + - N 的去除率与溶液 pH 和 NH4 +-N 的溶液浓度有直接关系,并且 CeO2-MnO2 复合金属氧化物催化剂可以重复使用至少 5 次,而没有显著的活性损失 。王智勇等[34] 对催化剂制备进行了优化处 理,加入超声、旋蒸工艺,使得前驱体溶液能够被吸收得更为均匀、充分,利用旋蒸能够保证活性组分的精确负载 。臭氧催化氧化更适用于低浓度模型化合物浓度,即低 COD 水体的 COD 去除,在结合一些物化处理手段的时候,处理能力能够明显提升 。常见的处理手段为膜处理、紫外、超声、加入双氧水、结合光催化等。
使用臭氧的主要目的是氧化与消毒,在此过程中会产生一些副产物 。溴酸盐是使用臭氧过程中产生的最常见的副产物 。在通常情况下,水中不含溴酸盐,但普遍含有溴化物 。当在水处理过程中采用臭氧等氧化剂时,臭氧化过程中会产生溴酸盐副产物 。许多研究表明,溴酸盐具有致癌和致突变性,饮用含有机物污染的饮用水与肝癌、胃癌、食道癌的发生有关。
Li 等[35] 水热合成了具有不同 Si/Ce 摩尔比的复合介孔筛 Ce-MCM- 48( 铈掺杂 MCM- 48) , 结果表明,当 Si/Ce 摩尔比为 66( 即 Ce66 - MCM-44) 时,能显著抑制含 Br 水臭氧化过程中溴酸盐( BrO3 — ) 的形成,在 pH 7 . 6 和 25 ℃ 下可以实现 91%的抑制效率 。酸性或碱性 pH 值在一定程度上影响了 Ce66- MCM- 48 的抑制效率,但反应温度在 15 ℃ 到 30 ℃ 之间波动时没有显著影响。
因此,氧化铈复合催化剂在催化臭氧处理废水领域不仅可以增强难降解有机微污染物的降 解,还可以对臭氧催化过程中产生的溴酸盐产生抑制效果 。 由于这些优点,氧化铈复合催化剂在臭氧水处理方面具有广泛的应用前景。
4.3 催化降解挥发性有机物
挥发性有机化合物( VOCs) 具有较高的蒸气压和较低的水溶性,被认为是空气污染的主要因 素 。去除挥发性有机化合物的技术有很多,包括吸附、吸收、冷凝、膜分离、催化氧化、热焚烧、非热等离子体、光催化降解和生物处理等,然而,每种技术在去除效率、能耗、副产物以及安全性方面都有其局限性,迫切需要一种能够在低温下完全氧化 VOCs 的技术 。臭氧已被证实在污染物氧化中比氧气更有效,此外,臭氧只分解成氧气,在处理过程中不留下残留物,因此臭氧可被应用于 VOCs 的消除( 图 4) , 即 VOCs 的催化臭氧氧化 。与传统的催化氧化相比,该方法大大降低了反应温度并显著节约了能量[36] 。

在挥发性有机化合物中,芳香族化合物是固定源排放的主要有害污染物之一 。在催化氧化 过程中,催化剂的选择显得尤为重要 。贵金属和过渡金属氧化物这两类催化剂已被广泛研究用 于催化降解卤化和非卤化化合物 。贵金属基催化剂拥有高比活性、抗失活性和再生能力,但成 本较高 。为了尽量减少这些贵金属的消耗量,希望开发具有高活性且含有少量贵金属的催化剂材料,因此稀土氧化物受到了 VOCs 催化氧化的关注 。CeO2 作为一种典型的稀土氧化物,由于 其高的储氧能力,已在多相催化中进行了研究, 它可以提供活性氧物种以确保催化反应 。最近, 基于 CeO2 的混合氧化物被用于去除 VOCs 并获得了满意的结果,如 Ce@ Mn 复合材料 。CeO2 - MnO x 物种可作为多相催化剂,用于减少液相和气相中的污染物,如催化还原 NO 和氧化丙烯酸 和甲醛,其催化活性远高于纯 MnO x 和 CeO2 [37] 。
Wang 等[38] 采用水热法合成了一种具有棒状形貌的 Ce-Mn 复合氧化物( Ce/Mn 摩尔比为 3 : 7) 。在 CeO2 框架中掺杂 Mn 离子来取代 Ce 离子,从而增加氧空位的浓度 。随着 Ce4+ 被 Mn 离子取代,形成了更多的氧空位,这是其活性较高的原因 。对于PdO/ Ce0. 3 Mn0. 7 , 活性相和载体之间的相互作用决定了除氧空位以外的催化性能 。Du 等[39] 采用氧化还原沉淀法和水热法相结合的新方法合成了 Mn-Ce 氧化物催化剂,发现锰和铈的比例对催化剂的形成起着至关重要的作用,并且显著影响了催化剂的性能和催化活性 。Mn0. 6 Ce0.4 O2 催化剂上丰富的 Ce3+ 和 Mn3+ 促进了氧空位的形成,并改善了催化剂中氧的转移;同时,锰铈氧化物中的铈在甲苯的吸附中起着关键作用,而锰被证明在甲苯的氧化中起着至关重要的作用,锰和铈之间的配合改善了催化反应过程。
4.4 光催化剂
任何光催化剂的关键特性都是它们的带隙值,带隙值越高表现出越低光催化活性 。二氧化铈的带隙值为 2 . 94 eV , 它能够在近紫外-可见光范围内使用光活化,因此二氧化铈在可见光下的光催化活性表现出优异的性能 。据报道,在二氧化铈光催化剂中添加 Au 能够提高其光催化活性,这种情况的发生是由于 Au 作为光吸收物种的作用,并随后驱动光催化活性。
纳米二氧化铈及其衍生物具有很强的氧化还原能力、高的氧储存/释放能力、环保性质、光稳定性和成本效益,尽管其带隙更大,但它们是环境可持续性的有前景的光催化剂 。合成条件极大地影响了二氧化铈的表面性质,因此研究人员提出了几种提高纯氧化铈光催化活性的策略。 在一项涉及一系列具有不同物理化学性质的纳米结构棒和立方体的研究中,表面氧缺陷对甲苯的光催化氧化贡献更大,而不是氧空位的总浓度,原因在于与纳米立方体相比,更多暴露的晶面会导致更高的表面积和更大浓度的表面缺陷[40] 。
Sun 等[41] 通过使用共沉淀法成功制备 Ce- Pr-Fe-O@ C , 具体机理为:首先,产物中形成了大量的碳键和氧空位,这有助于光生电子和空穴的分离;其次,催化剂表面的羟基有利于吸附有 机污染物;第三,由于碳的引入以及 Pr 和 Fe 的掺杂,该产品对可见光具有良好的吸收 。Pr、Fe、 C 的掺杂量在光催化活性中起着重要作用,并且在 CeO2 中引入适量的 Pr、Fe、C 可以极大地提高所得样品的光催化效率,因为其对污染物的吸附更好,对可见光的吸收更有效,碳带的形成速率越高,氧空位越多 。Ganesan 等[42] 制备的 CeO2 - GO 纳米复合材料提高的光催化活性归因于表面积增强、吸收强度、窄带隙和表面光响应效应。
Liu 等[43] 发现 Ce/CoWO4 复合催化剂是一种具有潜在应用价值的高效光催化剂 。CoWO4 表面的 CeO2 提供了更多的活性位点,提高了光生电荷分离的效率。CoWO4 表面的 CeO2 提供了 更多的活性位点,提高了光生电荷分离的效率。 Ce/CoWO4 复合催化剂是一种具有潜在应用价值的高效光催化剂 。CoWO4 表面的 CeO2 提供了更多的活性位点,提高了光生电荷分离的效率。
Petrovic 等[44] 采用恒电流电沉积法制备了 CeO2 催化剂,并用非热常压脉动电晕等离子体 对其进行了改性 。等离子体改性和非改性材料在等离子体和光催化降解过程中都表现出良好 的催化能力,这是由于比表面积更高,晶格中的缺陷( Ce3+ 离子和氧空位)含量更高,这些缺陷充当了催化活性位点。
5 结束语
氧化铈是一种具有重要技术意义的材料, 由于其独特的性质,如氧化还原特性、传输特性和储氧能力,可以有效地用于催化处理技术 。本文综述了氧化铈的合成方法对颗粒的形貌的影响,形貌对表面性质和催化活性的作用,以及氧化铈与掺杂剂和载体之间的协同效应及其应用 。虽然氧化铈基催化剂已经在催化领域被广泛研究与应用并取得了巨大进展, 解决了如水处理等环境问题,但仍然存在诸多实际问题,如铈负载催化剂的氧化铈形貌与负载物作用机理不明确,需要进一步研究催化剂的合成方法,增强组分之间的协同作用,研究不同负载物的催化机理。
参考文献
[1] TROVARELLI A , LEITENBURG C D , BOARO M , et al. The utilization of ceria in industrial catalysis[ J] . Ca- talysis Today, 1999 , 50(2) : 353 - 367 .
[2 ] HOU T F , YU B , ZHANG S Y , et al. Hydrogen production from ethanol steam reforming over Rh/CeO2 catalyst [ J ] . Catalysis Communications , 2015 , 58 ( 5 ) : 137- 140.
[3] ANTJE G , CHRISTIAN P , THOMAS H , et al. Effect ofY2 O3 and CeO2 on the crystallisation behaviour and me- chanical properties of glass - ceramics in the system MgO/Al2 O3 /SiO2/ZrO2 [ J ] . Journal of Materials Science , 2015 , 50(4) : 1986- 1995 .
[4] BAER D R , AMONETTE J E , ENGELHARD M H , et al. Characterization challenges for nanomaterials [ J ] . Surface and Interface Analysis , 2008 , 40 ( 3/4 ) : 529 - 537 .
[5] YULIA S , VERONIKA S , ILLIA T , et al. Synthesis of CeO2 nanoparticles by precipitation in reversal microe- mulsions and their physical - chemical and biological properties[ J] . Applied Physics A , 2019 , 125(6) : 412.
[6] CHEN J C , CHEN W C , TIEN Y C , et al. Effect of cal- cination temperature on the crystallite growth of cerium oxide nanopowders prepared by the coprecipitation process [ J ] . Journal of Alloys and Compounds , 2010 , 496(1) : 364- 369.
[7] SITI M , HADIAN M A , LENNO S K , SUGENG W , et al. Preparation of Ceria- zirconia mixed oxide by hydro- thermal synthesis[ J] . Modern Applied Science , 2015 , 9
(7) : 134- 139 .
[ 8] MARTIN F , BRATISLAV A , VLADIMIR G , et al. Mech- anosynthesis and structural characterization of nanocrys- talline Ce 1 - x Y x O 2 - δ ( x = 0. 1 - 0. 35 ) solid solutions[ J ] . Journal of Solid State Chemistry , 2015 , 230 : 42- 48 .
[9] ANDREOLI S , DEORSOLA F A , PIRONE R. MnO x - CeO2 catalysts synthesized by solution combustion syn- thesis for the low-temperature NH3- SCR[ J] . Catalysis Today, 2015 , 253 : 199- 206.
[10] ALAM B B , O ’TOOLE A W , MATYI R J , et al. Syn- thesis and characterization of ceria supported platinum via facile wet impregnation from cerium based precursors [ J ] . Journal of Advanced Chemical Engi- neering, 2015 , 5(2) : 1 - 5 .
[11] LI Y W , WANG H R , AROWO M , et al. Synthesis of nano-Ce0.5 Zr0.5 O2 by absorption of ammonia into water -in- oil microemulsion in a rotor - stator reactor [ J] . Journal of Nanoparticle Research , 2015 , 17(1) : 1 - 10.
[ 12 ] SURESH R , PONNUSWAMY V , MARIAPPAN R.
Effect of solvent and substrate temperature on morphol- ogy of cerium oxide thin films by simple nebuliser spray pyrolysis technique [ J] . Materials Technology , 2015 , 30(1) : 12- 22.
[13] MITSUDOME T , YAMAMOTO M , MAENO Z , et al.
One- step synthesis of Core- Gold/Shell - Ceria nano- material and its catalysis for highly selective semi- hydrogenation of alkynes[ J] . Journal of the American Chemical Society , 2015 , 137(42) : 13452- 13455 .
[14] SUN C W , LI H , CHEN L Q . Nanostructured ceria - based materials : synthesis ,properties , and applications [ J] . Energy & Environmental Science : EES , 2012 , 5
申明:该文章仅用于学术交流,若侵害本文作者权益,请联系网站负责人进行删除,谢谢!
管理员
该内容暂无评论