联系人:沈经理
手 机:16602150044
电 话:400-663-2276
地 址:上海市嘉定区华江公路688号凯迪大厦210室
纳米氧化镧对植物暗形态建成的影响
(来源:期刊-《中国稀土学报》-2022年5月10日)
郭梦蕾,陈琦,代汶昊,马昱,徐梅任,卢博辽,朱云龙,王丽红*
(江苏厌氧生物技术重点实验室,环境与土木工程学院,江南大学,江苏 无锡 214122)
摘要:稀土纳米颗粒(NPs)因能够改善植物生理代谢、促进种子萌发和生长发育及增加产量等而有望被应用于农业,但其对植物影响的机制仍不清楚。需在土壤中萌发的植物要经历一段在黑暗中发育的暗形态建成过程,该阶段对于植物后续生长至关重要,但稀土NPs对植物此过程的影响尚未报道。本文以模式植物拟南芥和纳米氧化镧(La2O3 NPs)分别为植物和稀土NPs的代表,探究不同剂量稀土NPs对植物暗形态建成的影响及机制。结果发现, 5、10、20和40 mg L-1 La2O3 NPs增大拟南芥下胚轴长度、顶端弯钩弯曲角度和原叶绿素酸酯含量,即La2O3 NPs促进拟南芥暗形态建成,且在20 mg L-1时促进作用最大。高效液相色谱和气相色谱结果显示,La2O3 NPs处理增加拟南芥赤霉素(GA)、生长素(IAA)和细胞分裂素(ZT)含量及GA/脱落酸(ABA)、IAA/ABA、ZT/ABA、GA/乙烯(ETH)、IAA/ETH、ZT/ETH,降低ABA和ETH含量,同样20 mg L-1La2O3 NPs处理对拟南芥内源激素影响程度最大。相关性分析表明,La2O3 NPs通过增加GA、IAA和ZT含量及GA/ABA、IAA/ABA、ZT/ABA、GA/ETH、IAA/ETH、ZT/ETH,抑制ABA和ETH含量,进而促进拟南芥暗形态建成。为进一步探究La2O3 NPs促进暗形态建成的原因,采用实时荧光定量PCR和蛋白质免疫印迹方法测定组成型光形态建成蛋白1 (COP1)和光敏色素互作因子3 (PIF3)的基因相对表达量和蛋白水平,发现La2O3 NPs 处理增加拟南芥COP1和PIF3基因相对表达量和蛋白水平,推测COP1和PIF3可能参与了La2O3 NPs通过内源激素对暗形态建成的调控。本研究可为阐明NPs作用于植物的机理和发展纳米农业提供理论依据。
关键词: 纳米氧化镧;暗形态建成;内源激素;COP1 ;PIF3
中图分类号:S184
联合国预测,2050 年世界人口将增至 97 亿,需要比 2012 年多 50%的粮食才能养活人类[1, 2]。为保障粮食安全,自 1970 年以来,人们致力于开发提高粮食产量的方法,包括推广良种、使用农药化肥、耕作机械化和改善灌溉系统等,但这些方法消耗了大量水和化石燃料,同时造成农田土地污染和地力降低等问题[3-7]。纳米农业将纳米颗粒(NPs)和技术运用于农业,在保障粮食安全同时促进农业绿色发展,因此具有广阔的应用与发展前景[6, 8, 9]。然而,纳米农业仍处于起步阶段,要实现纳米农业的快速发展,前提是明确 NPs 对植物生长发育的影响与机理[10]。稀土NPs 集稀土与NPs 的特性于一身,是一类重要的 NPs [11-13],其对植物生长发育的影响与机理已有大量报道。 例如,0~2000 mg L-1 纳米氧化铈可提高单子叶植物绒毛草和双子叶植物剪秋萝及芝麻菜种子萌发率,促进根系生长[14]。此外,5 和 50 mg L-1 纳米氧化镧 (La2O3 NPs)通过上调光下生长的幼苗期玉米木质素合成的核心基因 ZmPAL、ZmCCR2 和 ZmCAD6 表达量,增强了幼苗中富含木质素的质外体屏障而导致气孔导度和蒸腾速率降低,进一步降低幼苗根和叶生物量[15]。2000 mg L-1 La2O3 NPs 抑制光下萝卜、油菜、番茄、生菜、小麦、卷心菜和黄瓜的根系伸长[16]。28 d 龄萝卜暴露于 10 mg L-1 La2O3 NPs 光下生长 6 d 后,其贮藏根生物量提高了 18%;100 和 300 mg L-1 La2O3 NPs 处理分别使萝卜贮藏根生物量降低38%和 60%,抑制了叶片净光合速率、贮藏根表皮和木质部薄壁组织细胞壁果胶的合成[17] 。在正常和盐胁迫条件下,98 μgL-1 纳米氧化铈处理使水稻单株产量和千粒重增加,且水稻籽粒中直链淀粉和蛋白质含量无变化,在水稻籽粒中没有铈积累[18]。
综合已有研究发现,稀土 NPs 对植物生长发育的影响与植物发育阶段有关,目前研究集中在种子萌发、营养生长、生殖生长和产量形成等阶段。暗形态建成是在土壤中萌发的植物必经的发育阶段,该阶段幼苗只能依靠自身有限的营养储备完成一系列发育过程,包括下胚轴伸长、顶端弯钩形成和适量原叶绿素酸酯(Pchlide)的积累等,为穿透土壤后自养生长奠定基础[19-23]。可见,植物只有经过恰当的暗形态建成,才能保障自身后续正常生长发育。目前,仍不清楚稀土 NPs 对植物暗形态建成的影响及机理。植物激素是植物形态建成过程中的重要调控分子,例如:降低黑暗中生长豌豆中的内源赤霉素(GA)水平会导致幼苗下胚轴变短,两子叶分离且呈绿色以及顶端弯钩无法形成[24];生长素(IAA)的不对称分布引起下胚轴两侧的细胞扩张和分裂差异,导致外侧比内侧生长快,最终形成弯钩[25];乙烯(ETH)可引起暗中拟南芥幼苗的“三重”反应,即下胚轴和根伸长被抑制、下胚轴细胞径向膨胀和弯钩弯曲角度增大[21];脱落酸(ABA)会增加 GAI 和 RGA 等 DELLA 蛋白的水平,从而抑制 GA 信号,最终抑制 IAA 合成基因的表达,抑制暗中幼苗下胚轴的伸长[26]。那么,稀土NPs 是否通过内源激素影响植物暗形态建成呢?组成型光形态建成蛋白 1 (COP1)和光敏色素互作因子(PIFs) 可调控激素以影响植物暗形态建成[20],那么 COP1 和 PIFs 是否参与到稀土 NPs 通过内源激素对植物暗形态建成的调控中呢?
为此,本文以模式植物拟南芥和 La2O3 NPs 为研究对象,研究不同浓度 La2O3 NPs 对拟南芥暗形态建成的影响,从 COP1、PIF3 和内源激素角度揭示 La2O3 NPs 影响拟南芥暗形态建成的机制。该研究可为明晰稀土 NPs 对植物生长发育的影响提供参考,为纳米农业的发展提供理论依据。
1 材料与方法
1.1 植物培养与 La2O3 NPs 处理
取适量哥伦比亚生态型拟南芥(Col-0)种子,将种子表面消毒后于4°C 冰箱春化2 d,之后播种于含0、5 、10 、20 或 40 mg L-1 La2O3 NPs (99% ,<100 nm, Sigma-Aldrich,美国)的 1/2 MS 培养基(0.22% MS ,1%蔗糖,1%琼脂,pH 5.7)上,于 22°C 恒温培养箱 中黑暗培养 4 d。
1.2 暗形态建成指标测定
参照刘腊梅等研究,进行暗形态建成指标测定[27]。
1.3 激素提取及含量测定
IAA、GA、细胞分裂素(ZT)和 ABA 含量采用高效液相色谱法测定[28]。取 0.5 g 样品于预冷的研钵中, 加入 10 mL 预冷的 80%甲醇充分研磨,全程在弱光冰浴中进行。将匀浆转入离心管并密封,4°C 浸提。12 h 后离心(5000r/min,4°C,25 min),收集上清液。将残渣中的激素再提取一次(方法同上),合并上清液, 于 36°C 旋转蒸发,加水定容至 10 ml。加入 0.1 g 交联聚乙烯吡咯烷酮并充分震荡,于-80°C 冰箱快速冷冻,完全冻结后取出于 4°C 冰箱中融化,离心后得到内源激素初提液。初提液-20°C 完全冻结,冷冻干燥机冻干,用 4 mL 甲醇充分溶解,经 0.45 µm 滤膜过滤后用于 HPLC (Utimate 3000,Thermo Fisher,德国)测定。
ETH 含量采用气相色谱法测定[19]。取 0.5 g 样品 于 20 mL 顶空进样瓶,迅速密封,22°C 黑暗条件下放置 12 h,用于 GC-2030 岛津气相色谱仪(Nexis , SHIMADZU,德国)测定:色谱柱 Agilent 7890B (0.25μm,30 m × 0.32 mm),FID 检测器,检测器温度 220°C, 柱温 90°C,进样口温度 90°C,进样量 1 ml。
1.4 COP1 和PIF3 基因表达量测定
参照盛兰娣等研究,采用实时荧光定量 PCR (RT-PCR)方法进行 COP1 和 PIF3 基因表达量测定 [29]。引物序列见表 1。

1.5 COP1 和 PIF3 蛋白水平测定
参照刘腊梅等研究, 采用蛋白质免疫印迹 (Western Blot)方法进行 COP1 和 PIF3 蛋白水平测定 [27]。其中,检测 COP1 蛋白水平所用一抗为 anti-COP1,二抗为 goat anti-rabbit IgG;检测 PIF3 蛋白水平所用一抗为 anti-PIF3,二抗为 goat anti-rabbit IgG;检测 ACTIN 蛋白水平所用一抗为 anti-Actin,二抗为 goat anti-mouse IgG 。抗体均购自 PhytoAB 和亚科因 (Abbkine)。
1.6 数据处理
实验数据由 3 次独立实验得出,且进行 3 次生物学重复,结果以平均值±标准误差表示。通过单向 ANOVA 和 LSD 检验(p < 0.05)分析处理组间差异显著性。
2 结果与分析
2.1 La2O3 NPs 对拟南芥暗形态建成的影响
为探究 La2O3 NPs 对拟南芥暗形态建成的影响, 我们首先观测了用于表征暗形态建成的指标[20, 27, 30]:下胚轴长度、顶端弯钩弯曲角度和 Pchlide 含量。由图 1 得知,与对照(0 mg L-1 La2O3 NPs)相比,5 mg L-1 La2O3 NPs 处理对 Col-0 下胚轴长度和顶端弯钩弯曲角度无影响,Pchlide 含量增加 10.84%;10、20 和 40 mg L-1 La2O3 NPs 处理后,下胚轴长度、顶端弯钩弯曲角度和 Pchlide 含量分别较对照增加 15.48%、 31.59%和 11.26%,17.28%、38.14%和 9.11%,26.74%、53.22%和 19.05%,即与对照相比,随着 La2O3 NPs 剂量增大,下胚轴长度、顶端弯钩弯曲角度和 Pchlide 含量的增幅均先增加后降低,且 20 mg L-1 La2O3 NPs 处理时增幅最大。
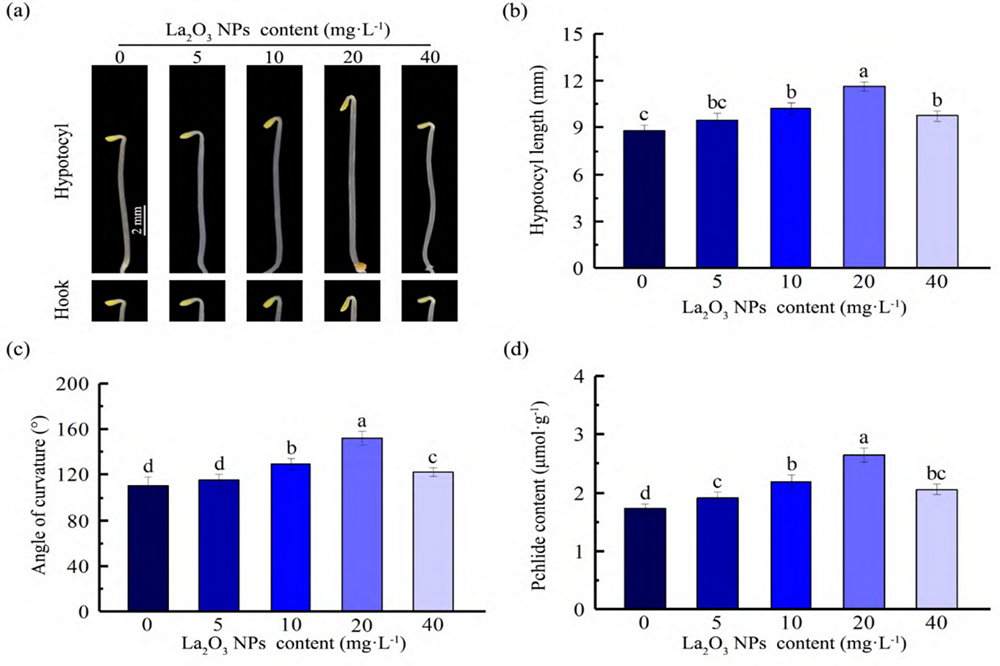
图 1 不同浓度 La2O3 NPs 对 Col-0 暗形态建成的影响。(a)生长表型,Bar=2 mm;(b)下胚轴长度;(c)顶端弯钩弯曲角度;(d) Pchlide 含量。不同处理组上字母不同表示处理组间差异显著(P < 0.05)。
Fig. 1 Effects of different concentrations of La2O3 NPs on the skotomorphogenesis of Col-0. (a) Growth phenotype,Bar=2 mm; (b) hypocotyl length; (c) apical hook angles of curvature; (d) Pchlide content. Different letters on different treatment groups indicate significant differences between treatment groups (P< 0.05).
2.2 La2O3 NPs 对拟南芥激素含量的影响
图 2 显示了不同浓度 La2O3 NPs 处理的 Col-0 激素的含量。与对照相比,Col-0 经 5 mg L-1 La2O3 NPs 处理后,IAA 和 ZT 含量无变化,GA 含量增加,ABA 和 ETH 含量减少。当用 10 、20 和 40 mg L-1 La2O3 NPs 处理Col-0 时,与对照相比,GA 和 IAA 含量增加,ZT 含量仅在 20 mg L-1 La2O3 NPs 处理时有所增加,ABA 和 ETH 含量减少,且 20 mg L-1 La2O3 NPs 处理时激素含量的变幅最大。
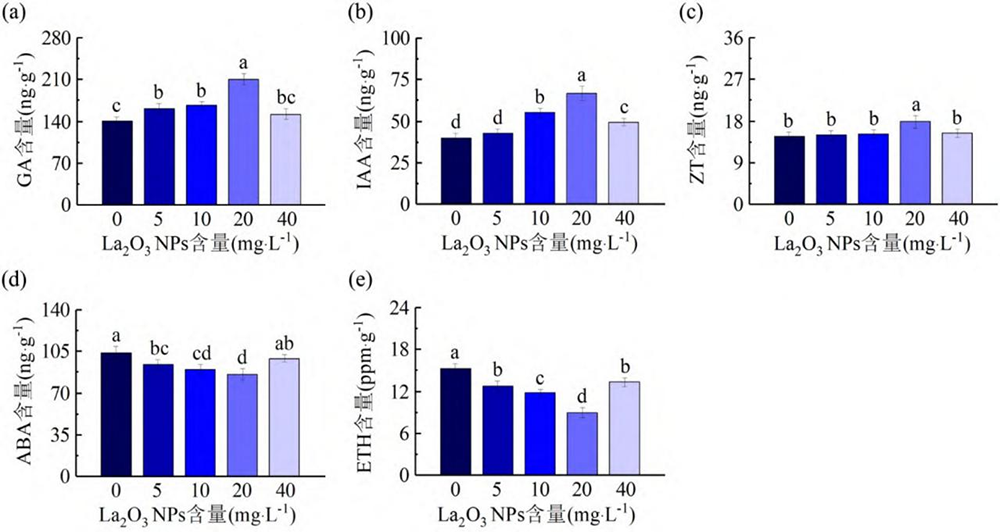
图 2 不同浓度 La2O3 NPs 对暗生长 4 d 的 Col-0 激素含量的影响。不同处理组上字母不同表示处理组间差异显著(P < 0.05)。
Fig. 2 Effects of different concentrations of La2O3 NPs on the contents of hormones in Col-0 after growing in dark for 4 days. Different letters on different treatment groups indicate significant differences between treatment groups (P <0.05).
2.3 La2O3 NPs 对拟南芥激素含量比值的影响
图 3 显示了不同浓度 La2O3 NPs 处理的 Col-0 激素含量比值。与对照相比,Col-0 经 5 、10、20 和40 mg L-1 La2O3 NPs 处理后,GA/ABA 、IAA/ABA 、 ZT/ABA、GA/ETH、IAA/ETH、ZT/ETH 均增大。随着 La2O3 NPs 剂量增大,GA/ABA 、IAA/ABA 、 ZT/ABA、GA/ETH、IAA/ETH、ZT/ETH 的增幅均先增大后减小,且 20 mg L-1 La2O3 NPs 处理时增幅最大。
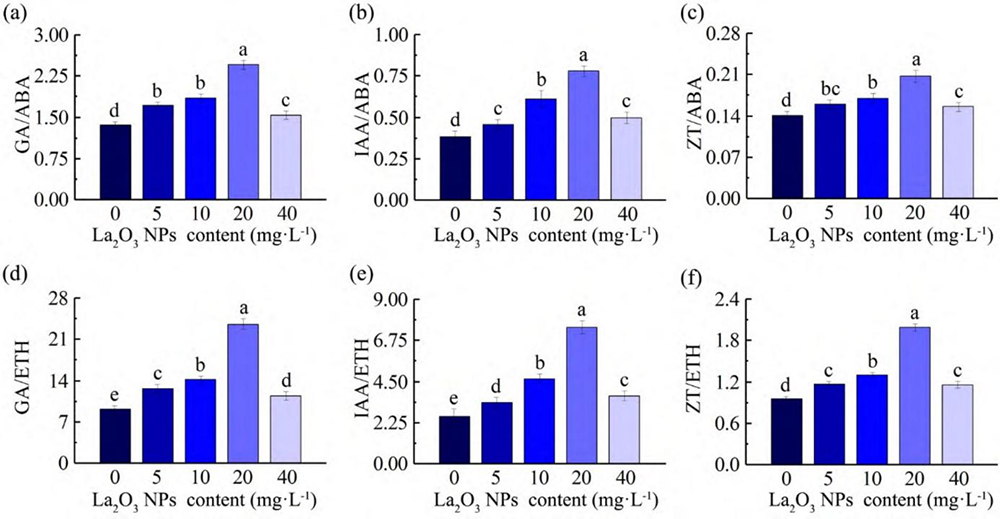
图 3 不同浓度 La2O3 NPs 对暗生长 4 d 的 Col-0 激素含量比值的影响。不同处理组上字母不同表示处理组间差异显著(P < 0.05)。
Fig. 3 Effects of different concentrations of La2O3 NPs on the ratios of hormone contents in Col-0 after growing indark for 4 days. Different letters on different treatment groups indicate significant differences between treatment groups (P < 0.05).
2.4 La2O3 NPs 作用下,暗形态建成指标与激素含量及其比值的相关性分析
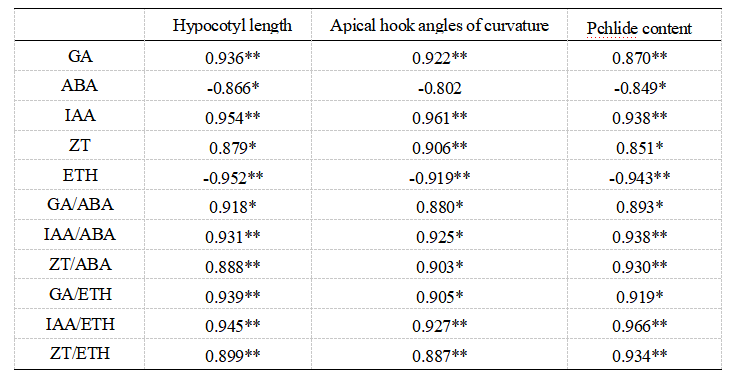
为表明 La2O3 NPs 处理下植物暗形态建成与激素含量或比值之间的关系,我们计算了 Col-0 暗形态建成指标与激素含量或比值的相关系数。结果显示,在 La2O3 NPs 处理下,三个暗形态建成指标均与 GA、 ZT 和 IAA 含量及 GA/ABA、IAA/ABA、ZT/ABA、 GA/ETH、IAA/ETH、ZT/ETH 呈正相关,下胚轴长度和 Pchlide 含量与 ABA 和 ETH 含量呈负相关,顶端弯钩弯曲角度与 ETH 含量呈负相关(表 2)。
表 2 La2O3 NPs 处理的 Col-0 暗形态建成指标与激素含量或比值的相关性
Table 2 After La2O3 NPs treatment, the correlation analysis between skomorphological indexes and hormone contents or ratios of Col-0(* P<0.05 ,** P<0.01 )
2.5 La2O3 NPs 对拟南芥 COP1 和 PIF3 的基因表达量与蛋白水平的影响
COP1 和 PIF3 在激素对植物暗形态建成的调控中发挥重要作用[20, 27],为探究 La2O3 NPs 处理为何引起内源激素含量变化,首先用 RT-PCR 测定 La2O3 NPs 处理后拟南芥COP1 和PIF3 基因的相对表达量, 结果如图 4a 和 b 所示。与对照相比,5~40 mg L-1 La2O3 NPs 使 Col-0 COP1 和PIF3 基因相对表达量增大,增幅随 La2O3 NPs 浓度增加先增大后降低,且20 mg L-1 La2O3 NPs 处理时增幅最大。然后,采用 Western Blot 测定 La2O3 NPs 作用后拟南芥 COP1 和 PIF3 蛋白水平(图 4c-e)。与对照相比,5~40 mg L-1 La2O3 NPs 增加 Col-0 COP1 和 PIF3 蛋白水平,增幅 随 La2O3 NPs 浓度增加先增大后降低,且20 mg L-1 La2O3 NPs 处理时增幅最大。
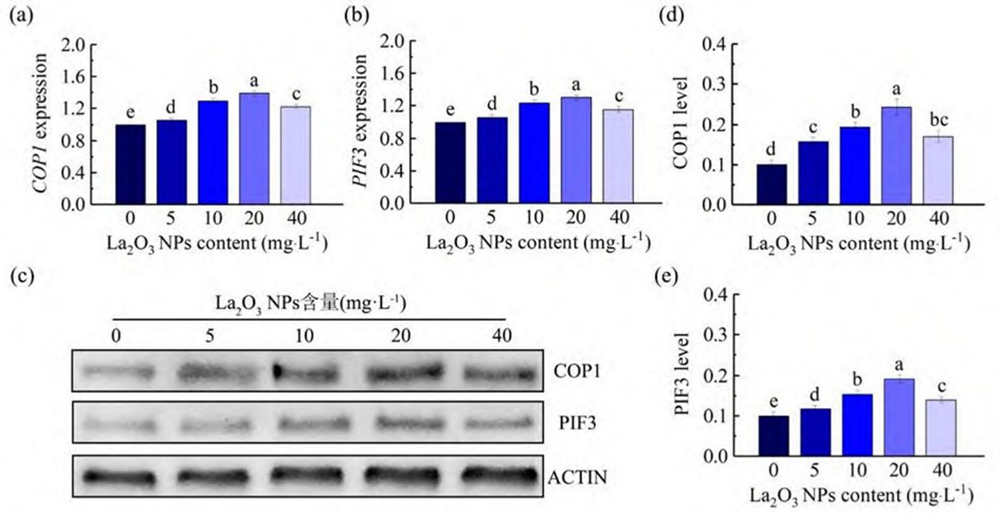
图 4 不同浓度 La2O3 NPs 对暗生长 4 d 的Col-0 COP1 和 PIF3 蛋白水平与转录水平的影响。不同处理组上字母不同表示处理组间差异显著(P < 0.05)。
Fig. 4 Effects of different concentrations of La2O3 NPs on the protein levels and transcription levels of COP1 andPIF3 in Col-0 after growing in dark for 4 days. Different letters on different treatment groups indicate significant differences between treatment groups (P < 0.05).
3 讨论
本文研究发现,经 5、10、20、40 mg L-1 (即 15 、 30 、60 、120 μM) La2O3 NPs 处理的暗生长拟南芥,其下胚轴长度、弯钩弯曲角度和 Pchlide 含量均增大 (图 1)。生命科学研究显示,种子于土壤中萌发后需借助下胚轴的伸长来实现破土[21]。弯钩弯曲角度增大,对子叶和顶端分生组织的保护越充分,幼苗出土后的成活率越高[31] 。Pchlide 是合成叶绿素途径中的关键中间体之一,Pchlide 含量增加,幼苗见光后能合成足够的叶绿素,快速建立光合作用机制,实现自养生长[27, 32, 33]。显然,La2O3 NPs 促进了拟南芥下胚轴伸长,增加了弯钩弯曲角度和 Pchlide 含量,为其出苗及出苗后的成活率提供了有力保障,出苗后快速建立光合机制,使其在后续发育中占据优势[21]。总之,La2O3 NPs 处理促进了拟南芥暗形态建成。而刘腊梅等人的研究显示,15 、30 、45 、55 μM LaCl3 处理拟南芥后,其下胚轴长度缩短、顶端弯钩弯曲角度增大和 Pchlide 含量降低,对拟南芥暗形态建成呈现抑制效应[27]。可见,La2O3 NPs 对植物暗形态建成的促进作用优于LaCl3,故在农业生产中可将La2O3 NPs 用于暗形态建成阶段促进植物生长。为何 La2O3 NPs 的作用优于 LaCl3 ?原因在于:(1) La2O3 NPs 应用时,会水解产生少量 La3+ ,进而执行低剂量 La3+ 的功能 [34];(2) La2O3 NPs 具备 NPs 的表面与界面效应[35] ,进而促进植物吸收水和矿质营养,提高抗氧化酶活性等[6, 9] ,半径较大,相对不易进入细胞发生富集现象[36];(3) 环境风险小,La2O3 NPs 比表面积大,提高农用化学品的功效和稳定性等[6]。此外,除了暗形态建成外,相同剂量的 La2O3 NPs 也会影响光下植物生长[16, 17, 37]。例如,光下生长的萝卜经 10 mg L-1 La2O3 NPs 水培6 d 后,其贮藏根生物量提高18%[17]; 0.8~20 mg L-1 La2O3 NPs 对光下油菜和小麦根系伸长无影响,当剂量大于 20 mg L-1 时,La2O3 NPs 抑制两种植物根系伸长[16];20 mg L-1 La2O3 NPs 不影响光下生长的黄瓜幼苗茎伸长,却抑制了茎的生物量[37]。因此,La2O3 NPs 农用时,还需根据作物种类与生育阶段决定施加 La2O3 NPs 的剂量。
遗传和生化证据表明,植物的形态建成过程由转录因子和植物激素组成的复杂网络调节[20, 26]。据报道,IAA、GA 和 ZT 通过参与细胞分裂、扩大和分化的调节来影响植物生长;ETH 和 ABA 是植物响应胁迫时产生的主要激素[28]。ABA、ZT、GA、IAA和 ETH 等都是调控植物暗形态建成的关键内源激素, 其水平的变化是影响植物暗形态建成的内在因素[20,21, 24-26, 28]。已有研究表明,植物暗形态建成中的下胚轴伸长依靠膨压的产生和细胞壁延展性的增强,顶端弯钩的形成由下胚轴顶端的两个对立面之间细胞分裂和延伸不对称引起,Pchlide 的合成与积累都会影响 Pchlide 含量[27, 32, 38, 39]。我们的结果显示,La2O3 NPs 通过增大 GA、IAA 和 ZT 含量,降低 ABA 和 ETH 含量来促进拟南芥暗形态建成(图 1 和2,表 2)。
我们推测,IAA 增多(图 2)可提高质膜 H+-ATPase 和 K+通道活性,降低质外体 pH 值,激活壁松散蛋白,并产生膨压,从而促进下胚轴伸长[40];GA 含量增加 (图 2)促进细胞壁中木葡聚糖(初生壁的主要成分)内糖转移酶的活性与细胞壁聚合物的生物合成,增大细胞壁延展性[38];ABA 一方面可使 H+-ATPase 去磷酸化(与 IAA 的作用拮抗),一方面提高 DELLA 蛋白水平来削弱 GA 信号,抑制下胚轴伸长,因此 ABA 含量减少(图 2)可促进下胚轴伸长[26];ETH 含量减少 (图 2),降低其响应因子 1 的稳定性而促进下胚轴伸长[38];ZT 通过其受体阿拉伯糖组氨酸激酶3 抑制下胚轴伸长[41],但结合 La2O3 NPs 处理使 Col-0 下胚轴伸长的结果来看(图 1) ,ZT 含量增加(图 2)对下胚轴的抑制效果甚微。HOOKLESS 1 (HLS1)是植物顶端弯钩发育过程中的重要角色,GA 、ETH、茉莉酸、水杨酸和油菜素内酯等激素都会参与到 HLS1 的转录调节中,从而影响弯钩发育;此外,IAA 在弯钩处的梯度分布是弯钩形成的关键因素[39, 42]。因此,我们推测,La2O3 NPs 处理 IAA 含量增加(图 2) ,可能会促进 PIN 蛋白和 B 类 ATP-结合转运蛋白中的 ATP 结合盒(ABCB1 和 ABCB19)对 IAA 的运输,有利于弯钩两对立面 IAA 浓度梯度的形成,而引起弯钩弯曲角度的增大[39];GA 含量增加(图 2) ,一方面可促进 IAA 运输载体 PIN 蛋白的基因表达和蛋白活性[43, 44],从而促进弯钩组织处 IAA 的不对称分布[39],另一方面可增强 HLS1 调控弯钩曲率的信号通路,促进弯钩形成[39, 43];ETH 含量的降低(图 2)不利于弯钩形成[23],但根据结果推测 ETH 含量降低对弯钩弯曲角度的抑制效果小于其它因子的促进效果。ETH 信号通路蛋白乙烯不敏感 3 (EIN3)/EIN3-LIKE1 (EIL1)可直接与编码 Pchlide 还原酶基因的启动子结合以下调其基因表达量,抑制 Pchlide 积累[25, 32]。因此推测, La2O3 NPs 处理 Col-0 后,ETH 含量降低可能使 EIN3/EIL1 水平下降,有利于 Pchlide 积累。此外,其它激素对 Pchlide 含量的影响机制仍未见报道。
激素对暗形态建成的影响并非单一激素的作用,而是通过与其它激素相互作用实现对植物暗形态建成的调控[20, 26]。实验结果表明,La2O3 NPs 通过增大 GA/ABA、IAA/ABA、ZT/ABA、GA/ETH、IAA/ETH、ZT/ETH 来促进拟南芥暗形态建成(图 1 和 3,表 2)。 GA 和 IAA 在植物暗形态建成阶段的作用存在增效效应,La2O3 NPs 处理使 GA 和 IAA 含量增多,可能会使彼此含量增多[45],有利于植物的暗形态建成。 La2O3 NPs 处理使植物 GA、IAA 和 ZT 含量增多,可能会使 ABA 和 ETH 含量减少[26];同样,ABA 和 ETH 含量减少,也可能使 GA、IAA 和ZT 含量增多,进而促进植物暗形态建成。原因在于:(1) GA 与 ABA 存在拮抗作用,GA 含量增多会抑制 DELLA 蛋白水平,而使 ABA 含量减少,有利于下胚轴伸长和顶端弯钩的形成[26];(2) IAA 有利于 H+-ATPase 磷酸化,ABA 使 H+-ATPase 去磷酸化,二者存在拮抗关系,且 ABA 会抑制 IAA 合成基因的表达,IAA 增加、ABA 减少导致下胚轴长度和弯钩弯曲角度的增大[26];(3)ETH 可抑制 IAA 的生物合成及极性运输,并促进 IAA 分解,ETH 含量减少导致 IAA 含量增加,而增大下胚轴长度和弯钩弯曲角度;(4) ZT 既可提高 1- 氨基环丙烷-1-羧酸合成酶的稳定性参与ETH 的生物合成又可促进 ETH 的信号转导,ETH 减少表示 ZT 得到了积累[41],可能对下胚轴伸长的抑制作用相对较小;(5) GA 含量增多导致 DELLA 蛋白水平下降,使 ETH 含量减少,促进下胚轴伸长、顶端弯钩形成 和 Pchlide 积累[46]。
分析激素含量和暗形态建成的结果发现,(1) 与其它激素相比,ZT 和 ABA 在 La2O3 NPs 调控拟南芥暗形态建成的贡献不大,表现为与对照相比,ZT 和 ABA 含量变幅较小。所以,La2O3 NPs 处理剂量从 20 mg L-1 转变为 40 mg L-1 时,ZT 和 ABA 含量易恢复到对照水平;(2) La2O3 NPs 处理剂量从 20 mg L- 1 转变为 40 mg L-1 时,ZT、ABA 和 GA 含量快速到达对照组的水平,IAA 和 ETH 含量变化较大;同时 La2O3 NPs 对暗形态建成的影响由促进效应向抑制效应方向转变。基于此我们推测,随着 La2O3 NPs 剂量的增加,对暗形态建成影响变化起调控作用的主要激素是 IAA 和 ETH;(3) 40 mg L-1 La2O3 NPs 处理时,与对照相比,虽然 ZT 和 ABA 未变,但 IAA 含量增加,ETH 含量降低,表明40 mg L-1 La2O3 NPs 引起暗形态建成变化的激素是 IAA 和 ETH 。另外, 由图 1 和图 2 可知,5 mg L-1 La2O3 NPs 主要通过调控 GA、ABA 和 ETH 含量来影响暗形态建成;10 mg L-1 La2O3 NPs 主要通过调控 GA、IAA、ABA 和 ETH 含量来影响暗形态建成;在 20 mg L-1 时是由 GA、IAA、ZT、ABA 和 ETH 共同参与了 La2O3 NPs 调控暗形态建成的过程。显然,随着 La2O3 NPs 剂量的增加,需要更多激素参与 La2O3 NPs 诱导的拟南芥下胚轴长度、弯钩弯曲角度和 Pchlide 含量的增加,至20mg L-1 La2O3 NPs 处理时最多。结合已有文献推知,20 mg L-1 La2O3 NPs 处理时 ZT 可能在转录后水平上稳定 PIFs 以促进顶端弯钩的维持等[47]。
研究表明,COP1 和 PIF3 可通过调控植物激素而影响暗形态建成[20, 26, 48]。我们的结果显示,La2O3 NPs 处理增大了 COP1 和 PIF3 的基因相对表达量和蛋白水平(图 4)。据报道,含有 COP1 的 E3 复合物通过 26S-蛋白酶体途径泛素化和降解光形态建成的转录促进因子,如 ELONGATED HYPOCOTYL5 (HY5) 和 LONG AFTER FAR-RED LIGHT 1,从而维持暗形态建成[49-53],故 COP1 的基因表达量和蛋白水平增大 (图 4)可能会促进此过程,有利于暗形态建成。COP1 可增加 PIF3 蛋白水平以维持暗形态建成[54-56],因此推测,La2O3 NPs 处理使 COP1 蛋白水平增大(图 4), 可能会诱导 PIF3 蛋白的合成增多(图 4)以维持暗形 态建成。含有 COP1 的 E3 复合物可通过降低 HY5 水平,上调 YUCCA8 基因表达,而促进 IAA 合成[57-59] 。 因此推测,La2O3 NPs 处理使 COP1 蛋白水平增大(图 4),可能会促进 IAA 合成(图 2),有利于下胚轴伸长 [40]。研究表明,COP1-PIFs 在黑暗下促进 ABA 信号通路[60, 61],因此 La2O3 NPs 处理后,COP1 和 PIF3 蛋白水平和基因表达量增加(图 4),应该会增加 ABA 含量,从而抑制下胚轴伸长[26]。但结果表明 ABA 含量下降(图2),因此推测在暗下La2O3 NPs 调控的COP1- PIFs 并非直接作用于 ABA 信号通路,具体机制仍待研究。
上述分析表明,La2O3 NPs 可能通过促进 COP1 和 PIF3 蛋白合成及基因表达影响内源激素从而促进拟南芥暗形态建成,但 La2O3 NPs 处理如何引起 COP1 和 PIF3 蛋白合成、基因表达和内源激素含量及比值的变化,以及这些变化对植物暗形态建成的影响机理仍需进一步研究。
4 结论
NPs 及技术将广泛应用于农业而促进粮食生产与安全,但由于 NPs 对植物的作用机制尚不明晰,导致该领域的发展仍处于萌芽期。本文研究了NPs 对植物暗形态建成阶段的影响及机制,结论为:5~40 mg L-1 La2O3 NPs 可能通过促进 COP1 和 PIF3 蛋白合成及基因表达而增加 GA 、IAA 和 ZT 含量及 GA/ABA、IAA/ABA、ZT/ABA、GA/ETH、IAA/ETH、ZT/ETH ,减小 ABA 和 ETH 含量,进而促进拟南芥暗形态建成。La2O3 NPs 对拟南芥暗形态建成的促进作用随处理浓度的增加而增大,且 20 mg L-1 La2O3 NPs 的促进作用最强。此结论表明 La2O3 NPs 可在农业中用于促进植物暗形态阶段的生长发育。
参考文献
[1] Kah M, Tufenkji N, White J C. Nano-Enabled Strategies to Enhance Crop Nutrition and Protection [J]. Nature Nanotech., 2019, 14(6): 532-540.
[2] Lowry G V, AvellanA, Gilbertson L M. Opportunities and Challenges for Nanotechnology in the Agri-Tech Revolution [J]. Nature Nanotech., 2019, 14(6): 517- 522.
[3] Garcia D, Zhao Y, Zhao S, Ming L C, Huang D.
Hydroelectrostatic Hybrid Priming Stimulates Germination Performance via ABA and GA Regulation: New Promising Evidence for Tomato Gene Expression [J]. Curr. Plant Biol., 2021, 27: 100215.
[4] Afshari F, Nakhaei F, Mosavi S, Seghatoleslami M. Physiological and Biochemical Responses of Stevia Rebaudiana Bertoni to Nutri-Priming and Foliar Nutrition under Water Supply Restrictions [J]. Ind. Crop. Prod., 2022, 176: 114399.
[5] Liu C X, Zhou H, Zhou J. The Applications of Nanotechnology in Crop Production [J]. Molecules, 2021, 26(23): 7070.
[6] Shang Y F, Hasan MK, Ahammed G J, Li M Q, Yin H Q, Zhou J. Applications of Nanotechnology in Plant Growth and Crop Protection: AReview [J]. Molecules, 2019, 24(14): 2558.
[7] Albiero D, Garcia A P, Umezu C K, Paulo R. Swarm Robots in Mechanized Agricultural Operations: AReview about Challenges for Research [J]. Comput. Electron. Agr., 2022, 193: 106608.
[8] Zahedi S M, Karimi M, Silva J. The Use of Nanotechnology to Increase Quality and Yield of Fruit Crops [J]. J. Sci. Food Agr., 2020, 100(1): 25-31.
[9] Li S, Liu J, Wang Y B, Gao Y, Zhang Z P, Xu J, Xing G M. Comparative Physiological and Metabolomic Analyses Revealed That Foliar Spraying with Zinc Oxide and Silica Nanoparticles Modulates Metabolite Profiles in Cucumber (Cucumis Sativus L.) [J]. Food Energy Secur., 2021, 10(1): 269.
[10] Pulizzi F. Nano in the Future of Crops [J]. Nature Nanotech., 2019, 14(6): 507.
[11] 崔静, 祁晶晶, 贺凤至, 张宇, 魏正贵. 稀土纳米 材料与植物相互作用研究进展 [J]. 中国稀土学报, 2019, 37(02): 141-153.
Cui J, Qi J J, He F Z, Zhang Y, Wei Z G. Research Progress on Interactions between Rare Earth Nanomaterials and Plants [J]. Journal of the Chinese Society of Rare Earths (in Chin.), 2019, 37(02): 141- 153.
[12] 郜建全, 贾国兴, 宋希文, 周芬,谢敏,包金小,安 胜利. 纳米 CeO2 的砂磨法制备及热稳定性能研究 [J]. 中国稀土学报, 2021, 39(06): 909-915.
Gao J Q, Jia GX, Song X W, Zhou F, Xie M, Bao J X, An S L. Preparation and High Temperature Stability for High Specific Surface Cerium Oxide by Sanding Method [J]. Journal of the Chinese Society of Rare Earths (in Chin.), 2021, 39(06): 909-915.
[13] 田皓, 崔建国, 王荣, 高婷, 陈禹夫, 张洋. 强化沉 淀反应结晶过程制备纳米稀土氧化物的工艺开发 [J]. 中国稀土学报, 2020, 38(04): 467-473.
Tian H, Cui J G, Wang R, Gao T, Chen Y F, Zhang Y. Technology Development of Preparation of Nanometer Rare Earth Oxides by Chemical Enhanced Process in Precipitation Crystallization [J]. Journal of the Chinese Society of Rare Earths (in Chin.), 2020, 38(04): 467-473.
[14] Lizzi D, Mattiello A, Piani B, Fellet G, Marchiol L.
Germination and Early Development of Three Spontaneous Plant Species Exposed to Nanoceria (n CeO2) with Different Concentrations and Particle Sizes [J]. Nanomaterials-Basel., 2021, 10(12): 2534.
[15] Yue L, Chen F R, Yu K Q, Xiao Z G, Yu XY, Wang Z Y. Early Development of Apoplastic Barriers and Molecular Mechanisms in Juvenile Maize Roots in Response to La2O3 Nanoparticles [J]. Sci. TotalEnviron., 2019, 653: 675-683.
[16] MaY H, Kuang LL, HeX, Bai W, Ding YY, Zhang Z Y, Zhao Y L, Chai Z F. Effects of Rare Earth Oxide Nanoparticles on Root Elongation of Plants [J]. Chemosphere, 2010, 78(3): 273-279.
[17] Xiao Z G, Yue L, Wang C X, Chen F R, DingY, Liu Y L, Cao X S, Chen Z, Rasmann S, Wang Z Y. Downregulation of the Photosynthetic Machinery and Carbon Storage Signaling Pathways Mediate La2O3 Nanoparticle Toxicity on Radish Taproot Formation [J]. J. Hazard. Mater., 2021, 411: 124971.
[18] Zhou H, Wu H H, Zhang F, Su Y, Guan W X, Xie YJ, Giraldo J P, Shen W B. Molecular Basis of Cerium Oxide Nanoparticle Enhancement of Rice Salt Tolerance and Yield [J]. Environ. Sci. Nano., 2021, 8(11): 3294-3311.
[19] 刘腊梅. 外源镧增强根胞吞作用对拟南芥暗形态 建成的影响 [D]; 无锡: 江南大学, 2021.
Liu L M. Effects of Exogenous Lanthanum on Skotomorphogenesis of Arabidopsis Thaliana by Enhancing Root Endocytosis [D]. Wuxi: Jiangnan Univeisity, 2021.
[20] Deepika, Ankit, Sagar S, Singh A. Dark-induced Hormonal Regulation of Plant Growth and Development [J]. Front Plant Sci., 2020, 11: 1-10.
[21] Ahammed G J, Gan Tait S, Mitra M, Yang Y, Li X. Role of Ethylene Crosstalk in Seed Germination and Early Seedling Development: A Review [J]. Plant
Physiol Biochem., 2020, 151: 124-131.
[22] Rovira A, Sentandreu M, NagataniA, Leivar P, Monte E. The Sequential Action of MIDA9/PP2C.D1, PP2C.D2, and PP2C.D5 is Necessary to Form and Maintain the Hook after Germination in the Dark [J]. Front Plant Sci., 2021, 12: 636098.
[23] Venkateswara K, Ravindran N, Bhagavatula L, Datta S. Molecular Mechanisms to Sense Soil Overlay and Optimize Emergence in Plants [J]. J. Plant Biochem. Biot., 2021, 30(4): 646-651.
[24] Alabadí D, Gil J, Blázquez MA, García-Martínez JL. Gibberellins Repress Photomorphogenesis in Darkness [J]. Plant Physiol., 2004, 134(3): 1050-1057.
[25] Gommers CMM, Monte E. Seedling Establishment: A Dimmer Switch-Regulated Process Between Dark and Light Signaling [J]. Plant Physiol., 2018, 176(2): 1061- 1067.
[26] Lorrai R, Alessandra B, Veronica R, Marco P, Paolo C, Paola V. Abscisic Acid Inhibits Hypocotyl ElongationActing on Gibberellins, DELLA Proteins and Auxin [J]. AoB Plants, 2018, 10(5): 61.
申明:该文章仅用于学术交流,若侵害本文作者权益,请联系网站负责人进行删除,谢谢!
管理员
该内容暂无评论